
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Цветные реакции на компоненты нуклеопротеинов
1) Биуретовая реакция – на белковый компонент Принцип Пептидная группа образует в щелочной среде с ионами Сu2+ комплексное соединение фиолетового цвета с красным или синим оттенком в зависимости от числа пептидных связей и состава аминокислот. Интенсивность окрашивания пропорциональна количеству пептидных групп. Проведение реакции В пробире смешать 5 капель гидролизата, 10 капель 10% раствора NаOH и 1 каплю 1% раствора CuSO4. 2) Серебряная проба – на пуриновые основания Принцип Пуриновые основания (аденин, гуанин), взаимодействуя с AgNO3,образуют через 5-10 мин рыхлый светло-коричневый осадок серебряных солей. Проведение реакции К 10 каплям гидролизата добавляют по 10 капель конц. NH4ОН и 1 % аммиачного раствора AgNO3. При стоянии образуется осадок характерной окраски. 3) Реакция Молиша – на углеводные группы Принцип (см. стр. 20) Проведение реакции К 10 каплям гидролизата добавляют 2‑3 капли раствора тимола, перемешивают. Осторожно по стенке добавляют конц. H2SO4 и, не перемешивая, оставляют пробирку на несколько минут для лучшего развития тёмно-розовой окраски на границе раздела H2SO4 и жидкой части пробы. 4) Молибденовая проба – на фосфорную кислоту Принцип Фосфорная кислота, взаимодействуя с молибденово-кислым аммонием в азотной кислоте, образует окрашенное в лимонно-желтый цвет комплексное соединение фосфомолибдата аммония. Проведение реакции К 10 каплям гидролизата добавляют 20 капель молибденового реактива. Нагревают в кипящей водяной бане. После охлаждения под струей воды в пробирке выпадает осадок лимонно-желтого цвета. Оформление работы Отмечают принцип метода, заносят результаты в таблицу, делают вывод.
Вопросы для самоконтроля 1) Строение пуриновых и пиримидиновых азотистых оснований, нуклеозидов и нуклеотидов, трифосфатных и циклических производных нуклеотидов. 2) Биологический смысл разнообразия азотистых оснований нуклеотидов. Азотистые основания нуклеотидов, не входящих в состав нуклеиновых кислот, функции моно‑ и динуклеотидов в организме.
3) Классификация и локализация нуклеиновых кислот. Строение нуклеиновых кислот, уровни структурной организации и стабилизирующие их связи. 4) Структура и биологическая роль нуклеопротеинов, состав и значение их белкового компонента, связи между белковым и небелковым компонентами. 5) Ураты как представители пуринов. Строение, происхождение мочевой кислоты, биологические нормы содержания в крови и моче. 6) Понятие о биологических и метаболических взаимосвязях между аминокислотами (белками) и нуклеиновыми кислотами. Тестовые задания Выбрать один правильный ответ. 1. Абсолютно незаменима для человека аминокислота 1) глицин 2) валин 3) тирозин 4) серин 2. При рН 7,4 положительно заряжена аминокислота 1) пролин 2) оксипролин 3) аргинин 4) аспартат 5) аспарагин 3. Простым белком является 1) гемоглобин 2) соматотропин 3) альбумин 4) церулоплазмин 4. В стабилизации третичной структуры белков в пространстве не участвуют 1) электростатические взаимодействия радикалов аминокислот 2) водородные связи 3) гидрофобные взаимодействия 4) дисульфидные мостики 5) взаимодействия простетических групп 6) пептидные связи 5. Центр узнавания белка лигандом представляет собой 1) место связывания белка и небелкового кофактора 2) "нишу" на поверхности белковой молекулы 3) гидрофильный фрагмент пептидного остова 4) участок белковой цепи, комплементарный лиганду 6. Пептид Асп-Лей-Глу-Гли при рН=6,8 в электрическом поле 1) движется к аноду 2) остается на месте 3) движется к катоду 7. Свойством белков, использованным в аппарате "искусственная почка", является 1) отсутствие способности проникать через полупроницаемые мембраны (диализ) 2) способность связывать полярные молекулы 3) создание онкотического давления 4) низкая скорость диффузии 8. Кооперативное взаимодействие в молекуле белка осуществляется на уровне 1) первичной структуры 2) третичной структуры 3) вторичной структуры 4) четвертичной структуры 5) надвторичной структуры 9. В случае денатурации ДНК возникает такое физическое явление как 1) изменение спектра поглощения
2) увеличение плавучей плотности 3) гиперхромный эффект 4) увеличение вязкости 5) увеличение отрицательного угла вращения плоскости 10. Первичная структура ДНК стабилизирована 1) SS-мостиками 2) фосфоэфирными связями 3) фосфодиэфирными связями 4) N-гликозидными связями 5) О-гликозидными связями Ситуационные задачи 1. Проведено осаждение белка из биологической жидкости, в которой создано 50%-ное насыщение сульфатом аммония. После отделения осадка жидкость стала прозрачной. Пояснить, какие белки осаждаются в данных условиях. Указать, достигнута ли полнота осаждения белка и способ для подтверждения этого. 2. В биохимической лаборатории исследуется электрофоретическая подвижность белков. Указать направление движения в электрическом поле (к аноду, катоду или остаются на старте) следующих белков: а) яичный альбумин при рН 5,0 (изоэлектрическая точка рН 4,6), б) b‑лактоглобулин при рН 5,0 и 7,0 (изоэлектрическая точка рН 5,2), в) химотрипсиноген при рН 5,0; 9,5; 11,0 (изоэлектрическая точка рН 9,5)? 3. При частичном гидролизе белка и последующем фракционировании получены два пептида: а) Гли–Ала–Вал–Лей–Иле; б) Тре–Асп–Лиз–Тир–Глу. Пояснить, какое из этих соединений более похоже по свойствам на углеводород, какое лучше растворимо в неводной жироподобной среде. Указать, как каждое из этих соединений ведет себя в случае проведения биуретовой пробы, нингидриновой реакции, реакции Фоля и ксантопротеиновой реакции, какое из них более способно к участию в образовании солевых мостиков Раздел 2. ТЕМА 2.1. Актуальность Ферменты ‑ белковые молекулы, выполняющие в живой клетке функции биокатализаторов. Знания о строении и функционировании ферментов необходимы для изучения обмена веществ и его регуляции, для понимания патогенеза заболеваний, связанных с нарушением функционирования ферментов и основ лекарственной терапии. Цель 1) Знакомство со строением, свойствами, классификацией ферментов, особенностями ферментативного катализа. 2) Изучение основных механизмов регуляции действия ферментов. 3) Знакомство с методами обнаружения ферментов в тканях, биологических жидкостях, освоение способов измерения активности ферментов. 4) Знакомство с ферментами — лекарственными препаратами. Вопросы для самоподготовки 1) Сходство и различия в действии ферментов и неорганических катализаторов. 2) Основные свойства ферментов: специфичность, термолабильность, зависимость активности от pH среды, концентрации субстрата. 3) Структурно-функциональная организация ферментов: простые и сложные белки-ферменты, полиферментные комплексы. Понятия «холофермент», «апофермент», «кофактор». Основные кофакторы (витамины, минералы и др.), классификация. 4) Изоферменты, множественные формы ферментов, их биологический смысл. 5) Механизмы катализа: принципы теорий Фишера «ключ-замок», Кошленда об индуцированном соответствии и гипотезы топохимического соответствия. 6) Регуляция ферментативной активности: влияние активаторов и ингибиторов, аллостерические механизмы, ковалентная модификация (ограниченный протеолиз присоединение-отсоединение фрагментов), белок-белковые взаимодействия, ассоциация-диссоциация протомеров, изменение количества фермента и концентрации субстрата в клетке. Компартментализация.
7) Принципы современной номенклатуры и классификации ферментов. Примеры названий ферментов (эмпирические, рабочие, классификационные). 8) Классы ферментов: оксидоредуктазы, трансферазы, гидролазы, лиазы, изомеразы, лигазы (синтетазы). Общая характеристика каждого класса, основные подклассы, биохимическая роль, примеры реакций. 9) Принципы количественного определения активности ферментов. Единицы активности ферментов (в системе «СИ» и другие). 10) Практическое использование ферментов в медицине: энзимопатология, энзимодиагностика, энзимотерапия. 11) Применение ферментов и их ингибиторов в качестве лекарственных средств. Самостоятельная работа Задание. Рассчитать активность фермента аргиназы в 1,2 мл экстракта печени, если за 10 мин в экстракте преобразовано 100 мкмоль субстрата. Представить искомую активность фермента в международных единицах, а также с использованием единиц системы СИ. Показать удельную активность этого фермента, если 1 мл экстракта печени содержит 50 мг белка. Для расчетов использовать приведенные теоретические предпосылки, примеры. 1. Активность ферментов определяют методами спектрофотометрии, полярографии, фотометрии, оценивая их активность по убыли субстрата или по образованию конечного продукта реакции за определенный промежуток времени. 2. Активность ферментов принято выражать в условных единицах, так как измерение абсолютных величин затрудняют ничтожно малые концентрации ферментов, сложность их выделения и идентификации. За международную единицу активности фермента (Е) принимают такое его количество, которое способно превратить 1 мкмоль субстрата за 1 мин при 30°С и других оптимальных условиях. Концентрацию фермента в растворе выражают в Е/мл или Е/л, то есть в международных единицах в расчете на 1 мл или на 1 л. За стандартную единицу в системе СИ (катал) принимают количество фермента, превращающее субстрат со скоростью 1 моль/сек (1 катал = 60 000 000 Е). Пример 1: если при инкубации 0,5 мл экстракта печени с раствором аргинина за 15 мин разложилось 120 мкмоль аргинина, то 0,5 мл экстракта содержит 120/15 = 8 Е аргиназы, активность которой будет 8/0,5 = 16 Е/мл или 16000 Е/л. Часто активность фермента выражают в расчете не на объем раствора, а на содержание белка, и получают удельную активность фермента, которую представляют в единицах активности на 1 мг белка (Е/мг).
Пример 2: если в 0,5 мл экстракта, содержащего 8 Е аргиназы, обнаружено 20 мг белка, то удельная активность равна 8/20 = 0,4 Е/мг. Лабораторная работа 1. Реактивы 1) 1 % раствор крахмала, 2) раствор Люголя. Материал для исследования Слюна, разведенная 1:10 (источник a‑амилазы). Приготовление разведения: 1-2 мин тщательно ополаскивают рот 50 мл воды, в центрифужную пробирку собирают 1 мл слюны, избегая вспенивания (объём пены не учитывают), доводят дист. водой до метки 10 мл, хорошо перемешивают. Принцип Гидролиз крахмала под действием амилазы проходит до дисахарида мальтозы через стадии образования декстринов. Нерасщепленный крахмал с йодом дает синее окрашивание. Декстрины в зависимости от размера молекул окрашиваются йодом: амилодекстрины в фиолетовые тона, эритродекстрины в красно-бурые, ахродекстрины и мальтоза не окрашиваются: желтый цвет соответствует цвету водного раствора йода. Проведение реакции 1. В пробирки (1, 2, 3, 4) вносят по 10 капель крахмала (раствор субстрата). В следующие пробирки (5, 6, 7, 8) ‑ по 10 капель разведенной слюны (источник a‑амилазы). Пробирки делят по парам: 1‑5, 2‑6, 3‑7, 4‑8. 2. Первую пару пробирок (1 и 5) помещают в баню со льдом (0°С). Вторую пару (2 и 6) оставляют при комнатной температуре (18‑22°С). Третью пару (3 и 7) помещают в водяную баню/термостат (38‑40°С). Четвертую пару (4 и 8) помещают в кипящую водяную баню (100°С). 3. Через 5 мин содержимое каждой пары пробирок объединяют, приливая раствор фермента к субстрату, инкубируют ещё 5 мин (условия те же). 4. Из 3-й пробирки отбирают на предметное стекло 3 капли смеси, добавляют каплю реактива Люголя (источник йода). Появление желтой окраcки указывает на завершение гидролиза крахмала амилазой до мальтозы. В этом случае с содержимым остальных пробирок проводят ту же качественную реакцию (с каплей реактива Люголя), оценивают результат. 5. Если окраска в 3-ей пробирке осталась фиолетово-бурых оттенков, то продолжают инкубацию проб ещё 3 минуты в тех же условиях. Затем в каждую пробирку добавляют по 2 капли реактива Люголя и наблюдают за развитием окраски. Оформление работы Указывают принцип метода, регистрируют результаты в таблице, делают вывод о зависимости скорости реакции от температуры
Лабораторная работа 2. Принцип Метод основан на сравнении скорости гидролиза крахмала под действием амилазы слюны до и после добавления ионов Cl‑ и Cu2+. Действие фермента на субстрат выявляется при помощи реакции с йодом. Реактивы: 1) 1 % раствор CuSО4, 2) 0,9 % раствор NaCl, 3) раствор Люголя. Материал для исследования
Слюна, разведенная 1:10 (источник a‑амилазы). Проведение реакции Готовят три опытные пробы. В 1-ю пробирку помещают 10 капель дист. воды, во 2-ю ‑ 10 капель раствора NaCl, в 3-ю ‑ 10 капель раствора CuSО4. В каждую добавляют по 10 капель разбавленной слюны, перемешивают, добавляют по 10 капель раствора крахмала, перемешивают, инкубируют 5 мин при 37°С. Готовят ещё три пробирки: в каждой из них по 1 мл воды и по 1‑2 капли реактива Люголя. Отбирают из опытных проб по 5 капель содержимого и прибавляют в соответствующие пробирки. Сравнивают окраску 2-й и 3-й проб с 1-й пробой (в которой нет ионов‑эффекторов). Если существенной разницы в окраске нет, инкубацию всех опытных проб увеличивают до 10 мин и повторяют качественный анализ на крахмал (с раствором Люголя). Оформление работы Указывают принцип метода, регистрируют результаты анализа и делают вывод о влиянии ионов хлора и меди на активность a‑амилазы, поясняя, какой из них является активатором, а какой ‑ ингибитором. Лабораторная работа 3. Реактивы 1) 1 % раствор мочевины, 2) 1 % раствор тиомочевины, 3) 0,5 % спиртовый раствор фенолфталеина, 4) лакмусовая бумага. Материал для исследования Препарат уреазы (готовит дежурный для всей группы: очищает 3‑4 семечка арбуза, зёрна тщательно растирает в ступке с 1 мл дистиллированной воды, доводит объём до 10 мл, полученную эмульсию фильтрует через воронку с двойным слоем марли: фильтрованную эмульсию используют как препарат уреазы). Принцип Метод основан на сравнении возможности гидролиза уреазой сходных по строению субстратов — мочевины и тиомочевины:
Специфичность действия уреазы обнаруживают по изменению окраски индикатора фенолфталеина (или лакмусовой бумаги) в присутствии аммиака, который образуется при гидролизе мочевины данным ферментом и защелачивает среду. Мочевина + Н2О Проведение реакции В 1-ю пробирку помещают 10 капель раствора мочевины, во 2-ю ‑ 10 капель раствора тиомочевины, затем в обе пробирки добавляют по 10 капель препарата уреазы и по 1‑2 капле фенолфталеина, перемешивают, наблюдают за появлением яркой розовой окраски в одной из пробирок. Оформление работы Указывают принцип метода, регистрируют результаты анализа, делают вывод о специфичности действия уреазы (тип специфичности), об её месте в классификации ферментов. Отмечают возможность использования полученных данных при оценке результатов в следующей лабораторной работе 4. Лабораторная работа 4. Реактивы 1) 1 % раствор крахмала (субстрат), 2) раствор Люголя, 3) 3 % раствор перекиси водорода, 4) 10 % раствор глюкозы, 5) раствор метиленового синего (акцептор).
|
||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 96; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.23.127.197 (0.067 с.) |
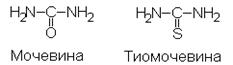
 2NH3 + CO2
2NH3 + CO2


