
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Экспресс метод с применением индикаторных полосок
Принцип Мочевина под действием фермента уреазы (класс гидролаз, оптимум рН 7,0‑7,2) разлагается с образованием аммиака, который окрашивает желтую полоску реактивной хроматографической бумаги в голубовато-зеленоватый цвет. Высота окрашенной зоны пропорциональна концентрации мочевины. Реактивы Индикаторная бумага «Уреатест» или «Уранал». Материал для исследования Сыворотка крови Проведение а нализа Конец хроматографической полоски, пропитанной ферментом, погружают в сыворотку крови (не смачивая красной полоски ‑ зона раздела). Бумажку помещают в чистую сухую пробирку, закрывают пробкой, оставляют на 30 минут при 37°С в термостате или водяной бане. Измеряют высоту (в мм) индикаторной зоны, окрашенной в голубовато-зеленоватый цвет, сравнивают ее со шкалой.
Практическое з начение Уровень мочевины в сыворотке крови зависит от скорости ее синтеза в печени, выделения почками и от величины белкового катаболизма. Повышение уровня мочевины: при заболеваниях почек (нарушении выделительной функции), нарушении почечной перфузии (застойная сердечная недостаточность), истощении запасов воды (рвота, понос), повышенном катаболизме белка, при диете с высоким содержанием белка. Снижение: при диете с низким содержанием белка, повышенной утилизации белка в тканях (поздние сроки беременности), тяжелых заболеваниях печени, сопровождающихся нарушением синтеза мочевины (паренхиматозная желтуха, гепатиты, цирроз печени). Оформление работы Указывают принцип метода, регистрируют данные, делают расчеты, сравнивают полученные результаты с нормальными значениями, формулируют вывод о наличии/отсутствии патологических отклонений, о возможных заболеваниях, отмечают практическую значимость. Вопросы для самоконтроля 1) Пути образования и связывания аммиака в реакциях обмена веществ. Токсичность аммиака для организма. 2) Транспортные формы аммиака. Доставкав реакции биосинтеза и к местам выведения. Роль аланинового цикла в удалении аминного азота из работающей мышцы. 3) Механизмы синтеза глутамина, мочевины, солей аммония, креатина и креатинина, локализация синтезов, ферменты и коферменты, энергетика процессов.
4) Органная локализация образования и выведения конечных продуктов азотистого обмена, возможные причины нарушения процессов при различных патологических состояниях. Тестовые задания Выбрать один правильный ответ. 1. Биологическая ценность белков обусловлена 1) порядком чередования аминокислот в молекуле белка 2) аминокислотным составом 3) молекулярной массой белков 4) зарядом белковой молекулы 5) включением небелковых компонентов 2. Для нейтрализации токсичных веществ, образующихся в толстом кишечнике, в печени присутствует фермент 1) гексокиназа 2) аминотрансфераза 3) глюкуронилтрансфераза 4) сахараза 5) аденозиндезаминаза 3. Энтеропептидаза является активатором фермента 1) пепсиноген 2) трипсиноген 3) химотрипсиноген 4) проэластаза 5) проаминопептидаза 4. Активный фермент глутаматдегидрогеназа содержит 1) никотинамидадениндинуклеотид (НАД+) 2) флавинадениндинуклеотид (ФАД) 3) флавинмононуклеотид (ФМН) 4) пиридоксальфосфат (ПАЛФ) 5) пиридоксаминфосфат (ПАМФ) 5. Серотонин в реакции декарбоксилирования образуется из 1) гистидина 2) триптофана 3) тирозина 4) 5-гидрокситриптофана 5) 5-гидроксилизина 6. Образование g-аминомасляной кислоты катализирует 1) гистидиндекарбоксилаза 2) тирозинмонооксигеназа 3) глутаматдекарбоксилаза 4) орнитиндекарбоксилаза 5) триптофандекарбоксилаза 7. В состав аминотрансферазы входит кофермент 1) никотинамидадениндинуклеотид 2) флавинадениндинуклеотид 3) тиаминдифосфат 4) пиридоксальфосфат 5) никотинамидадениндинуклеотид фосфорилированный 8. Синтез соляной кислоты в желудке стимулирует 1) тирамин 2) гистамин 3) дофамин 4) триптамин 5) ГАМК 9. При гиповитаминозе С нарушен обмен аминокислоты 1) тирозина 2) лейцина 3) метионина 4) цистеина 5) изолейцина 10. Связывание аммиака происходит при 1) синтезе глутамата из 2-оксоглутарата 2) синтезе креатина 3) трансаминировании аланина 4) синтезе серотонина 5) переаминировании аспартата Ситуационные задачи Ответы подробно пояснить. 1. Больного беспокоят боли в области желудка, отрыжка с неприятным запахом «тухлых яиц», урчание и газообразование в кишечнике. Указать, какие процессы могут быть причиной появления такого запаха. Дать рекомендации для нормализации процессов пищеварения.
2. У больного при поступлении в стационар жалобы на аллергические явления. Указать, содержание какого биогенного амина и активность какого фермента целесообразно определить. Пояснить, что является предшественником этого амина. 3. У ребёнка содержание в крови фенилаланина 5 мкмоль/л при норме 0,2 мкмоль/л, он выделяется в большом количестве с мочой. Пояснить, какие процессы обмена нарушены, как называется заболевание, как вскармливать ребёнка. 4. Накопление аммиака в клетках мозга является непосредственной причиной нарушения психического состояния при циррозах печени. Причиной токсического действия аммиака считают вторжение его в энергетический метаболизм клетки. Пояснить возможный механизм его токсического действия. Раздел 7. ТЕМА 7.1. Актуальность Существуют два типа нуклеопротеинов: дезоксирибонуклеопротеины (ДНП) и рибонуклеопротеины (РНП). Они играют важную роль в хранении и реализации наследственной информации. Белковые компоненты нуклеопротеинов подвергаются превращениям, свойственным всем белкам. Помимо роли структурных компонентов нуклеиновых кислот мононуклеотиды могут выполнять иные важные функции: 1) цикл АДФ‑АТФ участвует в трансформации энергии окисления веществ в энергию, используемую в эндергонических процессах организма; 2) адениловая кислота входит в состав коферментов дегидрогеназ (НАД, НАДФ, ФАД) и кофермента ацилирования (КоА); УТФ, ГТФ и ЦТФ выполняют роль коферментов в реакциях переноса моносахаридных остатков; ЦТФ служит коферментом холинтрансферазы; 3) циклические нуклеотиды 3’5’‑цАМФ и 3’5’‑цГМФ являются посредниками при передаче гормональных и иных сигналов на внутриклеточные эффекторные системы. Нуклеиновые кислоты не являются незаменимыми пищевыми факторами, и практически все клетки организма способны к синтезу нуклеотидов. Скоростью синтеза пуриновых и пиримидиновых нуклеотидов определяется синтез нуклеиновых кислот. К заболеваниям, связанным с патологией обмена нуклеопротеинов, относятся подагра, мочекаменная болезнь, синдром Леша-Нихана, оротацидурия, мегалобластическая анемия и другие. Нуклеотиды ‑ лекарственные препараты успешно применяются в клинике с лечебной целью. Цель 1) Знакомство с биосинтезом и катаболизмом пуриновых и пиримидиновых нуклеотидов, процессами репликации ДНК. 2) Освоение методов количественного определения мочевой кислоты в сыворотке крови и моче. Вопросы для самоподготовки 1) Переваривание нуклеопротеинов и васывание продуктов их распада в желудочно-кишечном тракте. Катаболизм нуклеиновых кислот в клетке. 2) Реакция образования 5‑фосфорибозиламина, источники атомов азота и углерода пуринового кольца при синтезе ИМФ. Основные этапы синтеза АМФ и ГМФ из ИМФ, превращение нуклеозидмонофосфатов в трифосфаты. 3) Реакции синтеза УМФ и ЦМФ, превращение их в трифосфаты, нарушение метаболизма пиримидинов при оротацидурии.
4) Образование дезоксирибонуклеотидов, роль тиоредоксина и НАДФН в этом процессе, связь с фазами клеточного цикла. 5) Синтез дТМФ, ферменты, катализирующие процесс, роль метилен-ТГФК. 6) Регуляция синтеза пуриновых и пиримидиновых нуклеотидов по типу обратной связи, ее особенности. 7) Реакции образования мочевой кислоты из АМФ и ГМФ, содержание мочевой кислоты в крови и моче. 8) Молекулярные механизмы развития мочекаменной болезни, синдрома Леша-Нихана, подагры. Диета при гиперурикемии, причины эффективности аллопуринола при лечении подагры. 9) Распад пиримидиновых нуклеотидов, конечные продукты процесса, их утилизация и судьба. Отличительные особенности распада пуриновых и пиримидиновых нуклеотидов. 10) Ингибиторы синтеза пуриновых и пиримидиновых нуклеотидов. Нуклеотиды ‑ лекарственные препараты. 11) Нуклеотидные коферменты, представление об их образовании. Нуклеотиды как активаторы метаболитов в реакциях обмена веществ. 12) Биосинтез ДНК: суммарное уравнение репликации, система синтеза ДНК, ориджин репликации, ферменты репликации, основные этапы и особенности репликации на разных нитях ДНК, ошибки и репарация ДНК. 13) Связь биосинтеза ДНК с фазами клеточного цикла. Локализация синтеза ДНК в клетке: ядро и митохондрии. Синтез ДНК при репликации и феномен обратной транскрипции. Теломераза. 14) Созревание молекул ДНК (смысл метилирования нуклеотидов и др.). Организация нуклеопротеинов при формировании хромосом, взаимодействие ДНК с гистонами, механизмы упаковки в хромосомы. Самостоятельная работа Заполнить столбец «Репликация» таблицы матричных биосинтезов.
Лабораторная работа 1. Титрометрический метод (оценка в моче) Принцип Мочевая кислота восстанавливает фосфорновольфрамовый реактив с развитием синей окраски, интенсивность которой пропорциональна количеству мочевой кислоты. Количество образовавшейся фосфорновольфрамовой сини определяют титрованием гексацианоферратом калия, который окисляет фосфорновольфрамовую синь и окраска исчезает.
Реактивы 1) 20% раствор Na2CO3, 2) фосфорновольфрамовый реактив, Материал для исследования Моча. Проведение а нализа В колбу наливают 5 мл мочи, добавляют 2 мл фосфорновольфрамового реактива и 10 мл раствора Na2CO3, перемешивают. Используя мерную пипетку на 10 мл с фингером или штатив с бюреткой, (осторожно!) по каплям приливают раствор K3[Fe(CN)6] до исчезновения синего окрашивания и фиксируют объём, пошедший на титрование. Расчет СОП = где СОП ‑ концентрация мочевой кислоты в пробе, ССТ ‑ концентрация стандартного раствора мочевой кислоты (соответствует 1 мл раствора K3[Fe(CN)6] ‑ 0,004 моль), В ‑ взятый для анализа объем мочи, А ‑ количество пошедшего на титрование раствора K3[Fe(CN)6] в мл, Д ‑ суточный диурез (1200‑1500 мл). Ферментативный метод (оценка в крови и моче) Ферментативным методом можно определять концентрацию мочевой кислоты в плазме крови, сыворотке крови и моче. Принцип Мочевая кислота с помощью уриказы окисляется до аллантоина и СО2 с образованием пероксида водорода. Пероксид водорода в присутствии фермента пероксидазы (КФ 1.11.1.17.) окисляет хромогены ‑ 3,5‑дихлор‑2‑гидроксибензол-сульфонат натрия (ДХГБС) и краситель 4‑аминоантипирин ‑ в окрашенное соединение (красный квинон). Интенсивность окраски пропорциональна содержанию мочевой кислоты. Материал для исследования Сыворотка крови, моча (разбавленная в 5 раз дистиллированной водой). Реактивы 1) Рабочий реагент (уриказа, пероксидаза, 4‑аминоантипирин, ДХГБС, калий железосинеродистый, ЭДТА в боратном буфере), 2) 500 мкмоль/л стандартный раствор мочевой кислоты. Проведение анализа
Расчет Содержание мочевой кислоты в сыворотке: С [мкмоль/л] = в моче: С [мкмоль/(л×сут)] = где ЕОП ‑ оптическая плотность пробы, ЕСТ ‑ оптическая плотность стандарта, ССТ ‑ концентрация стандартного раствора (калибратор), Нормальные величины Сыворотка и плазма крови женщины 150‑310 мкмоль/л мужчины 230‑500 мкмоль/л Моча 1,5‑4,5 ммоль/сут Практическое з начение Содержание мочевой кислоты в крови (мононатриевая соль в комплексе с белком) определяется интенсивностью ее синтеза организмом и выделением с мочой. Повышение содержания мочевой кислоты (гиперурикемия) наблюдается при уменьшении выведения ее почками или избыточном образовании при всех заболеваниях, связанных с распадом нуклеопротеинов (лейкозы, лечение цитостатиками, облучение). У таких больных наблюдается образование мочевых камней. Гиперурикемия является главным симптомом подагры, когда мочевая кислота откладывается в тканях, суставных сумках, хрящах, сухожилиях, а суточное количество в моче снижается. Белки сыворотки стабилизируют ураты, но при снижении pH мочевая кислота кристаллизуется в тканях. Гиперурикемия является компонентом метаболического Х-синдрома
Гипоурикемия отмечается при анемии, приеме салицилатов, кортикотропина. Гиперурикурия (увеличение экскреции уратов) наступает при воздействии солей лития. Гипоурикурия (уменьшение экскреции мочевой кислоты) может быть следствием отравления солями тяжелых металлов, заболеваний почек, употребления алкоголя. Оформление работы Указывают принцип метода, регистрируют результаты, сравнивают полученные данные с нормальными значениями, делают вывод о наличии патологических отклонений, отмечают практическую значимость работы. Вопросы для самоконтроля 1) Превращение нуклеопротеинов в желудочно-кишечном тракте, в клетках организма. 2) Биосинтез пуриновых и пиримидиновых нуклеотидов, дезоксирибонуклеотидов и регуляцию этих процессов. 3) Распад пуриновых и пиримидиновых нуклеотидов. Сравнение молекул – источников атомов для синтеза азотистых оснований и конечных продуктов их распада. Мочевая кислота, роль в организме, подагра. 4) Значение нуклеотидов в процессах обмена веществ. Роль нуклеотидов в биосинтезе нуклеиновых кислот. 5) Хранение информации о белке, генетический код, принципы синтеза ДНК. Механизмы и ферменты репликации, исправление ошибок, теломераза, созревание и упаковка ДНК. ТЕМА 7.2. Актуальность Белки клетки находятся в состоянии динамического равновесия, то есть непрерывно обновляются. Знание механизмов матричных биосинтезов, способных считывать и реализовать генетическую информацию о белке, и принципов их регуляции необходимо для понимания молекулярных основ возникновения наследственных заболеваний, а также рационального использования химиотерапевтических средств. Цель 1) Изучить основные этапы биосинтеза белка и механизмы его регуляции. 2) Освоить методы определения количества белка в растворе. 3) Познакомиться с современными методами лабораторной диагностики по оценке экспрессии генов. Вопросы для самоподготовки 1) Строение транскриптона ДНК, экзоны и интроны. Генетический код, его свойства. 2) Этапы и ферменты транскрипции. Кэпирование, полиаденилирование, процессинг матричной РНК. Особенности процессинга транспортной и рибосомальной РНК. 3) Основные компоненты белоксинтезирующей системы. 4) Адапторная роль транспортной РНК. Синтез аминоацил‑тРНК, специфичность аминоацил‑тРНКсинтетазы. 5) Строение и функционирование рибосом. Последовательность реакций при синтезе полипептидной цепи. 6) Регуляция биосинтеза белка путем индукции и репрессии (схема Жакоба-Моно). 7) Посттрансляционная модификация белковых молекул. Значение. 8) Возможность нематричного образования пептидной связи, ферменты и значение при синтезе важнейших пептидов (на примере синтеза/распада глутатиона в процессе транспорта аминокислот в клетку). 9) Лекарственные препараты – активаторы и ингибиторы матричных синтезов. 10) Современные методы оценки экспрессии генов (ИФА, ПЦР и другие).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 56; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.120.109 (0.05 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
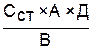

 × 5 × V: 1000,
× 5 × V: 1000,


