
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
V. Общие свойства растворов. Осмос.
Эбулиоскопия. Температура кипения раствора по сравнению с температурой кипения растворителя повышается на Δt = t ─ tоградусов, t – температура кипения раствора, tо – температура кипения растворителя, Δt = E×Cm Е – эбулиоскопическая постоянная растворителя, таб.1., Cm− моляльная концентрация раствора. Если G1(г) масса растворителя; G2(г) масса растворенного вещества; M2 - молярная масса растворенного вещества, тогда Криоскопия. Температура замерзания раствора по сравнению с температурой замерзания растворителя понижается на Δt = tо ─ t градусов, tо – температура замерзания растворителя, t – температура замерзания раствора, Δt = К×Cm градусов; К – криоскопическая постоянная растворителя, [m] = моль/кг моляльность раствора
G1(г) – масса растворителя G2(г) – масса растворенного вещества. Если G1(г) масса растворителя; G2(г) масса растворенного вещества; тогда масса раствора G0 = G1 + G2 = ρ×V и G2 = ρ×V×δ
Таблица 1.
5.3 Осмотическое давление π = R×T×С (Уравнение Вант – Гоффа) [C] = моль/ литр (молярная концентрация); R = 8,314, [π] = кПа Т = Т0К, G2(г) = масса растворенного вещества. М – молярная масса растворенного вещества, V[мл] – объём раствора. Изотонический коэффициент электролитов При растворении электролитов за счет диссоциации молекулы электролита увеличивается число частиц в растворе, поэтому опытные значения Δ t и π всегда больше, чем теоретические значения. Поэтому при вычислении Δt и π вводят поправочный (изотонический) коэффициент i > 1, учитывающий увеличение частиц в растворе. Для не электролитов i = 1. Если при диссоциации электролита образуется n ионов, тогда i = 1 +(n – 1)×α. α − степень диссоциации электролита.
α = n/N, N – общее число частиц в растворе. Как правило, степень диссоциации определяют экспериментально. Для сильных электролитов α > 0,45. Решение задач Задача. Вычислить температуру замерзания раствора CaCl2, если α = 0,35 и 222 кг соли растворили в 1 м3 воды. CaCl2 = Ca+ + 2Cl− Решение: Δt = i×K×Cмл, Смл – моляльная конц. раствора, i = 1+(3−1)×0,35 = 1,7 tзам = t0 – Δt = 00C – 6,320C = − 6,320 Задача. Вычислить температуру замерзания раствора содержащего 12 г формальдегида НСНО (М=30) в 400г воды. Решение: Задача. Ск. граммов С3Н6О (М=58) надо растворить в 1000мл воды, чтобы понизить температуру замерзания раствора на 2,79 оС. Решение: Задача. Вычислить М, если 60 г. вещества растворили в 1000 мл воды и раствор кипит при 101,04оС. Е = 0,52 (литр×градус)/моль Решение: Задача. Вычислить осмотическое давление раствора глюкозы, если в 250 мл раствора растворено 18г глюкозы (М = 180) при t = 27оC. Решение: 5.6 Задачи для самостоятельного решения Вычислить, как связаны друг относительно друга Δt (замерзания/кипения/осмос) при одинаковой ω% растворов этанола и метанола Вычислить температуру замерзания раствора содержащего 12 г формальдегида НСНО (М=30) в 400г воды. Вычислить, ск. граммов С3Н6О (М=58) надо растворить в 1000 мл воды, чтобы понизить температуру замерзания раствора на 2,79 0С. Вычислить М, если 60 г вещества растворили в 1000 мл воды и раствор кипит при 101,04оС. Е = 0,52(литр×градус)/моль При одинаковой массовой доле растворенного вещества осмотическое давление коллоидного раствора по отношению к истинному раствору имеет меньшее или большее значение? Осмотическое давление раствора, в 250 мл которого содержится 3 г сахара, при 12оС равно 83,14 кПа. Вычислить относительную молекулярную массу сахара.
|
|||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 65; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.39.32 (0.006 с.) |
||||||||||||||||||||||||||||||||||||||||
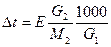 . Если ρ – плотность раствора, V – объем раствора, тогда масса раствора G0 = G1 + G2 = ρ×V. С другой стороны, массовая доля растворенного вещества
. Если ρ – плотность раствора, V – объем раствора, тогда масса раствора G0 = G1 + G2 = ρ×V. С другой стороны, массовая доля растворенного вещества  , следовательно,
, следовательно, 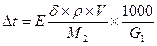 .
. ;
; 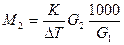 ; М2 - молярная масса растворенного вещества,
; М2 - молярная масса растворенного вещества, ;
;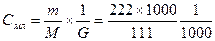 = 2(моль/кг); Δt = 1,7×1,86×2= 6,320C
= 2(моль/кг); Δt = 1,7×1,86×2= 6,320C Ответ: 1,86оС.
Ответ: 1,86оС.
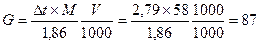 ; Ответ: 87 г
; Ответ: 87 г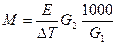
 Ответ: 30 (Н2СО формальдегид)
Ответ: 30 (Н2СО формальдегид) ≈ 998 кПа
≈ 998 кПа


