
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет концентрации кристаллогидрата в растворе
Если для приготовления раствора используются кристаллогидраты (напр., медный купорос CuSO4×5H2О или глауберова соль Na2SO4×10H2О и так далее), тогда при приготовлении раствора необходимо учитывать воду, которая входит в состав кристаллогидрата. Если m(kr) масса кристаллогидрата в граммах, m(B) масса безводного компонента кристаллогидрата в граммах, M(kr) молекулярная масса кристаллогидрата, M(B) молекулярная масса безводного кристаллогидрата, тогда: Задача. Ск. надо взять медного купороса, чтобы приготовить 500 г 16% раствора сульфата меди CuSO4. M(kr) = 250, M(CuSO4) = 160. Решение: для приготовления 500 г 16% раствора соли надо взять х(г) соли: Задача. Какое количество медного купороса (CuSO4•5H2O) вступило в реакцию с едким натром, если при этом получено 0,196 г гидроксида меди. Решение: из уравнения реакции видно, что в осадок выпадает такое же количество гидроксида меди, как и количество медного купороса, которое вступило в реакцию: CuSO4 + 2NaOH = Cu(OH)2 + Na2SO4. 0,196г Cu(OH)2 это 0,196/98 = 0,002 моля гидроксида меди, а это 0,002×250 = 0,5г медного купороса. Концентрация газа в растворе При нормальных условиях (н.у.) один моль газа занимает объем 22,4 л. Если масса газа m(г), и (н.у.), газ занимает объем Плотность газа Нормальные условия (н.у.) t = 0oC = 273К; P = 1 атм = 1,01×105 Па Стандартные условия: t = 25oC = 298К, P = 1 атм. Уравнение состояния газа: R = 8,314, 1 м3 = 1000 л; 1 л = 1000 мл. Задача. В 200 г воды растворили 50 л газа (н.у.) HCl (36,5). Вычислить процентную концентрацию газа в растворе. Решение: 50 л газа (н.у.) это 50/22,4 ≈ 2,23 моля газа, а это 2,23×36,5 = 81,40 г газа. Газофазные растворы Пример газофазного раствора – воздух. Состав воздуха – 21% кислорода, 78% - азота, 1% - остальные газы. Средняя молярная масса воздуха – 29. Для смеси газов справедлив закон Дальтона: давление газовой смеси равно сумме парциональных давлений всех входящих в неё газов Р = ∑рi. Если объем газовой смеси V, тогда парциальное давление компонента газовой смеси равно давлению этого компонента при условии, что он один занимает весь объем V. Тогда
Газовые уравнения и законы. Уравнение Клапейрона – Менделеева: Cm – молярная концентрация раствора. P = CmRT [P] = кПа; [m] – масса газа, граммы; R = 8,314 [Дж/(моль×К], [V] = литр.
Уравнение Клапейрона – Менделеева для смеси газов:
[P] = кПа; [m] – масса газа, граммы; R = 8,314 [Дж/(моль×оК], [V] = литр.
Законы Авагардо: 1 моль любого газа содержит 6,022×1023 молекул; При н.у. [T = 273,15оK, P = 101325 Па = 1,013 бара] один моль газа занимает объем 22,4 литра. Плотность газа при н.у. Решение задач Задача. Сухой воздух имеет состав 78,09% N2, 20,95% О2, 0,93% Ar и 0,03% СО2. Определить массу сухого воздуха в комнате объемом V = 40 м3 при t = 22оC и нормальном давлении Ро = 101,325 кПа. Решение: уравнение для смеси газов Msr = ∑δi×Mi = 0,7809×28 + 0,2095×32 + 0,0003×44 = 29
Задача. В баллоне объемом 2000 м3 смешали 1кг N2, 2 кг О2 и 3 кг Н2. Вычислить парциальные объемы газов и парциальные давления газов в баллоне при 17оС. TоK = 273 + 17 = 290оC. Решение: парциальное давление газа в баллоне парциальный мольный объём газа давление газов в баллоне P = (∑ni ×RT)/V Число молей газа в баллоне:N = ∑ni = 1000/28,02 + 2000/32 + 3000/2 = 35,71 + 62,5 + 1500 = 1598,21 Давление газов в баллоне Р = [1598,21×8,314×290]/(2000×1000) л = 1,927кПа. Парциальное давление газа:
Парциальный мольный объем газа:
Задача. Вычислить, ск. литров воздуха потребуется для сжигания 10 кг угля, содержащего 1% примеси. Кислорода в воздухе 20%. Решение: С + О2 = СО2. Масса углерода в 10 кг угля 10×0,99 = 9,9кг. При сжигании 1 моля угля (12г) потребуется 1 моль О2(32г); при сжигании 9,9кг угля (это 9900/12= 825молей) потребуется 825 молей кислорода, или 825/0,2 = 4125 молей воздуха. 1 моль воздуха это 22,4 л., 4125 молей это 92400 л или 92,4 м3.
III. Процессы в растворах Масса вещества в растворе: m = ρ×V×δ; m = C×M×V; m = H×Mэкв×V Выпаривание Вычислить процентную концентрацию раствора поваренной соли, полученном после выпаривания 300 г воды из 800 г раствора с 10% концентрацией соли. Решение: масса соли в 800 г раствора m = δ×m(раствора) = 0,1×800 = 80 г. После выпаривания масса раствора m = 800 – 300 = 500 г. Осаждение из раствора Задача. Вычислить, какая масса хлората калия KClO3 выкристаллизуется из 50 г насыщенного при 100оС раствора соли, если раствор охладить до 20оС. Растворимость хлората калия при 20оС равна 7,3 г/[100г Н2О], а при 100о – 56,2 г/[100г Н2О]. Решение: при 100оС раствор содержит 100г воды и 56,2г растворенной соли, поэтому масса раствора будет 100 + 56,2 = 156,2г. В 50г насыщенного раствора при 100оС воды будет m(г); составим пропорцию: в 156,2г раствора воды –100г в 50,0г раствора воды – m(г), откуда m = 32г, соли 50 – 32 = 18 г. Далее, пусть при 20оС в 32г воды растворится р(г) соли, а по условию задачи, в 100г воды растворяется 7,3г соли. Пропорция: в 32г воды растворится р(г) соли, в 100г воды растворится 7,3г соли, р = 2,3 г, масса соли, выкристаллизовавшейся после охлаждения раствора равна 18 – 2,3 = 15,7 г. Ответ: 15,7 г. Задача Ск. мл 0,2M раствора NaCl надо добавить к 150 мл 0,16H раствору AgNO3, чтобы осадить все находящееся в растворе серебро. Решение: 1×NaCl + 1×AgNO3 = 1×AgCl + 1×NaNO3; H(NaCl)×V(NaCl) = N(AgNO3)×V(AgNO3) H – нормальность раствора. Нормальность NaCl равна молялрной концентрации соли: 0,3×Vx = 0,16×150; Vx = 80 ml Задача. Вычислить объем 0,1М раствора карбоната натрия (Na2CO3), необходимого для осаждения ионов кальция (Са2+) из раствора, содержащего 0,324 г гидрокарбоната кальция Са(НСО3)2 Решение: Na2CO3+ Са(НСО3)2= 2NaHCO3 + CaCO3↓ Чтобы реакция протекала до конца, необходимо, чтобы 1 моль Na2CO3 (106 г) прореагировали с 1 молем Са(НСО3)2 (162 г). Для 0,324 г Са(НСО3)2 потребуется Х(г) Na2CO3: из пропорции 106↔162 X ↔ 0,324 X=0,212 г. Для осаждения 0,324 г ионов Са2+ потребуется 0,212 г Na2CO3 В 1 литре 0,1М раствора щелочи → 10,6 г Na2CO3 в V(л) “ должно быть → 0,212 г V = 0,02 л = 20 мл. Ответ: 20 млl. Задача. Вычислить массу осадка, выпадающего при слиянии 40мл 25% раствора NaOH (ρ = 1,27г/мл) и 60мл 0,5M раствора FeCl3. Решение: 1FeCl3 + 3NaOH = 1Fe(OH)3↓ + 3NaCl; M[FeCl3] = 161; M[NaOH]=40; M[Fe(OH)3]=107 На основании закона эквивалентности, для компонентов реакции должна выполняться пропорция: V1×H1 = V2×H2, где V и Н – объём и нормальность соответствующего раствора. Вычислим V×H для раствора щелочи. V = 40 мл,
Для соли FeCl3 V = 60 ml, k = 3, H = k×C = 1,5. H×V = 90; следовательно, щелочи взято с избытком и pасчёт теперь поведем по FeCl3. Из уравнения реакции следует, что если в реакции расходуется 1 моль FeCl3, в осадок выпадает 1 моль Fe(OH)3 Вычислим, ск. молей соли прореагировало: n = m/M = C×V = 0,5×0,06 = 0,03 моля, значит, в осадок выпадет 0,03×107 = 3,21г Fe(OH)3. Ответ: 3,21 г. Задача. Вычислить массу осадка, который образуется при сливании 20мл BaCl2 и 15мл 0,2M раствора серной кислоты H2SO4. Решение: BaCl2 + H2SO4 = BaSO4↓ + 2HCl Чтобы реакция протекала до конца, необходимо выполнение пропорции: 20×Н = 15×0,1; H(BaCl2) = 0,075;
C(BaCl2) = 2×0,075 = 0,15 моль/л. Следовательно, образуется 0,15 моля BaSO4. В 20мл 0,15M раствора масса BaSO4 Задача. Вычислить массу осадка, который образуется при слиянии 30 мл 0,1M раствора CaCl2 и 20мл 0,2M раствора (NH4)2C2O4 M[CaCl2] = 110, M[(NH4)2C2O4] = 144, M[CaC2O4] = 128 Решение: CaCl2 + (NH4)2C2O4 = CaC2O4↓+ 2NH4Cl; вычислим число молей CaCl2 в 30 мл раствора:
|
|||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 261; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.65.65 (0.027 с.) |
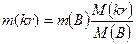 ;
; 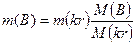
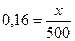 х = 80г.
х = 80г. 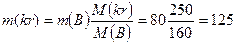 г. Ответ: 125 г.
г. Ответ: 125 г.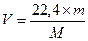 (литров).
(литров).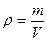 , m – масса газа, V – объем газа.
, m – масса газа, V – объем газа.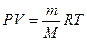 [P] – Па, [V] – м3, [m] – г,
[P] – Па, [V] – м3, [m] – г,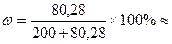 28,6%.
28,6%.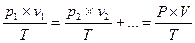 и v1 + v2 + v3 + … = V
и v1 + v2 + v3 + … = V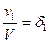 объемная доля газа, входящего в состав смеси газов:
объемная доля газа, входящего в состав смеси газов: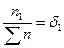 молярная доля газа;
молярная доля газа; 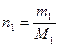 число молей газа 1; М1 = молярная масса газа 1.
число молей газа 1; М1 = молярная масса газа 1.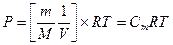 ;
;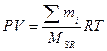 , MSR = M1×δ1+ M2×δ2 + M3×δ3 + ..средняя мол. масса смеси газов
, MSR = M1×δ1+ M2×δ2 + M3×δ3 + ..средняя мол. масса смеси газов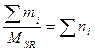 - число молей газа в смеси, P×V = ∑ni ×RT
- число молей газа в смеси, P×V = ∑ni ×RT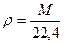 [г/л].
[г/л].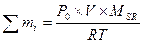
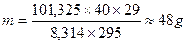 Ответ: 48 г.
Ответ: 48 г.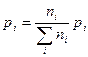
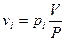
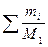 =
=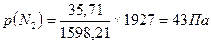 , р(О2) =75Па, р(Н2) = 1809Па
, р(О2) =75Па, р(Н2) = 1809Па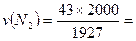 44,6 м3, v(O2)=77,84 м3, v(H2) = 1877,53 м3
44,6 м3, v(O2)=77,84 м3, v(H2) = 1877,53 м3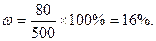
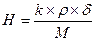 ; для NaOH k = 1, ρ = 1270 г/л, δ=0,25, М=40. Н=7,94, H×V ≈ 318
; для NaOH k = 1, ρ = 1270 г/л, δ=0,25, М=40. Н=7,94, H×V ≈ 318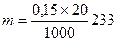 =0,699 г.
=0,699 г.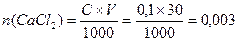 . Число молей (NH4)2C2O4 в 20 мл раствора
. Число молей (NH4)2C2O4 в 20 мл раствора 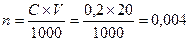 , т.е. (NH4)2C2O4 в избытке, следовательно, расчет следует вести по CaCl2; В реакции хлорида кальция прореагировало 0,003 моля, CaC2O4 образовалось так же 0,003 моля или 0,003×128 = 0,384 г = 384 мг.
, т.е. (NH4)2C2O4 в избытке, следовательно, расчет следует вести по CaCl2; В реакции хлорида кальция прореагировало 0,003 моля, CaC2O4 образовалось так же 0,003 моля или 0,003×128 = 0,384 г = 384 мг.


