Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаимодействие с азотной кислотой – нитрование фенола. ⇐ ПредыдущаяСтр 5 из 5
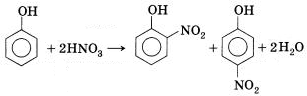
Фенол легко нитруется – при действии на фенол разбавленной азотной кислоты образуется смесь орто- и пара- нитрофенола:
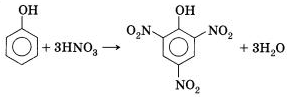
При действии концентрированной азотной кислоты (в избытке кислоты) образуется пикриновая кислота – 2,4,6-тринитрофенол:
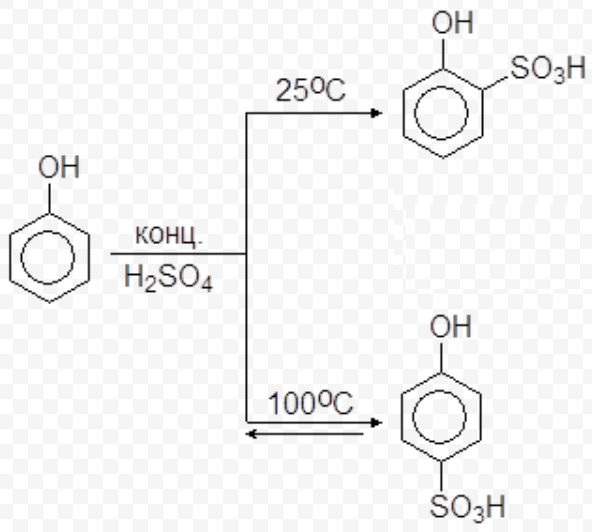
Пикриновую кислоту и её соли, пикраты, используют как взрывчатые вещества. Взаимодействие с азотной кислотой – сульфирование фенола. Интересно, что при комнатной температуре образуется в основном орто-фенолсульфокислота, а при кипячении – пара-фенолсульфокислота:
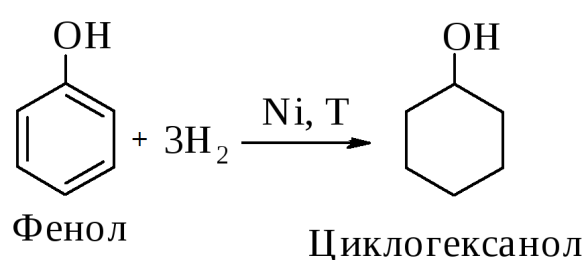
4) Гидрирование фенола, разрушение ароматического кольца:
циклический спирт
III Реакции окисления. 1) Горение фенола:
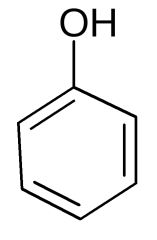
2) Даже на воздухе фенол окисляется – при хранении белые кристаллы фенола окрашиваются в розовый цвет, под действием сильных окислителей фенол полностью переходит в хиноны:
Двухатомные фенолы еще легче окисляются и также переходят в хиноны:
парабензохинон
Ароматические спирты
Ароматические спирты – это соединения, в которых гидроксильная группа находится в боковой цепи, то есть, не связана непосредственно с бензольным ядром, например:
простейший ароматический спирт
По способам получения и химическим свойствам ароматические спирты похожи на алифатические. Ароматические альдегиды и кетоны Ароматические альдегиды и кетоны содержат карбонильную группу, связанную с бензольным кольцом:
Ароматические альдегиды и кетоны отличаются от алифатических несколько меньшей реакционной способностью.
Ароматические кислоты Ароматические кислоты – производные ароматических углеводородов, у которых в бензольном ядре один или несколько атомов водорода замещены карбоксильными группами. Наличие бензольного ядра увеличивает кислотные свойства: они сильнее алифатических. Надо знать простейшую ароматическую кислоту – бензойную:
Также в ЕГЭ встречаются изомерные двухосновные фталевые кислоты:
(1,2-бензолдикарбоновая кислота)
(1,3-бензолдикарбоновая кислота)
(1,2-бензолдикарбоновая кислота)
Большое значение имеют и гетерофункциональные соединения, содержащие карбоксильную группу:
(2-гидроксибензойная кислота)
(эфиры салициловой кислоты по ОН-группе)
Ароматические кислоты образуют сложные эфиры, например:
Терефталевая кислота и ее эфиры – основа многих полимеров. Например, при поликонденсации терефтелевой кислоты с этиленгликолем
образуется полиэтиленгликольтерефталат (обычно его называют полиэтилентерефталат, ПЭТ), в России этот полимер называют лавсан по аббревиатуре ЛАборатории Высокомолекулярных Соединений Академии Наук, где он был получен в 1949 г. Этот полимер используется для производства пластиковых бутылок, прозрачных прочных нитей, волокон.
Ароматические амины
Рассмотрим только простейший ароматический амин – аминобензол или анилин:
Анилин – маслянистая жидкость с резким запахом, малорастворимая в воде. см. видео https://youtu.be/BdP9Xgbe0xg?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
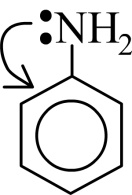
Особенность анилина – взаимное влияние аминогруппы и бензольного кольца. Главное отличие анилина от аминов предельного ряда – неподеленная электронная пара азота вовлекается в бензольное кольцо:
поэтому азот анилина, в отличии азота аммиака и аминов, в меньшей степени способен образовывать донорно-акцепторные связи с Н+. Анилин более слабое основание, чем предельные амины и аммиак, его раствор не обнаруживает щелочную реакцию. Анилин не реагирует с водой (не образует гидроксидов) и не изменяет окраску индикаторов.
см. опыт https://youtu.be/8vsB95fs6Ls
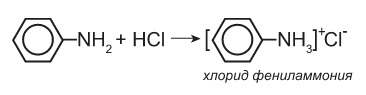
Анилин способен реагировать только с сильными кислотами (соляной, серной) образуя соли фениламмония
см. опыт https://youtu.be/NjmJ8YLRoxI
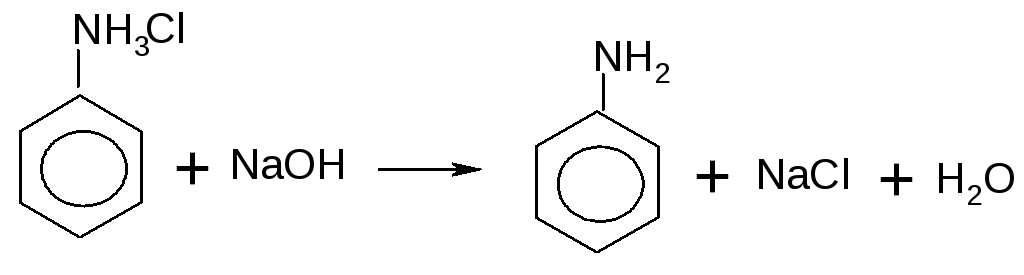
Как соли слабого основания, соли фениламмония реагируют со щелочами с образованием анилина:
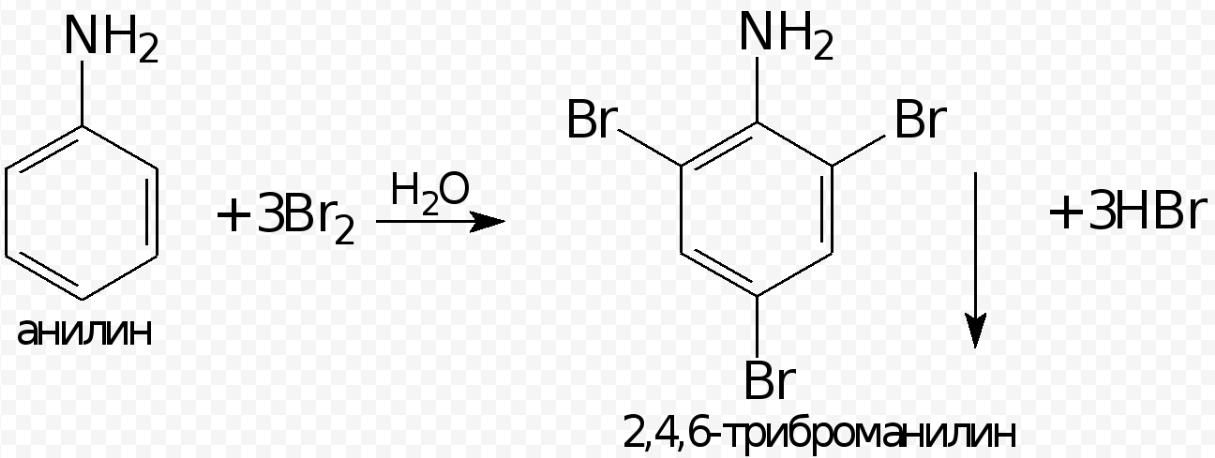
Главное отличие анилина от ароматических углеводородов – анилин обесцвечивает бромную воду. Так как аминогруппа является заместителем I рода и облегчает реакции замещения в бензольном ядре, анилин реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина:
см. опыт https://youtu.be/3Kc76xYuetc
В отличие от аминов алифатического ряда, анилин легко окисляется, даже на воздухе он темнеет. Сильными окислителями анилин окисляется до различных хинонов от фиолетового до черного цвета. Например, при взаимодействии анилина с K2Cr2O7 образуется краситель «анилиновый черный». Анилин используется в производстве красителей и лекарств.
см. опыты https://youtu.be/od3PMioRfRI https://youtu.be/WHAVBS-k5zs
|
||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 259; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.29.219 (0.013 с.) |

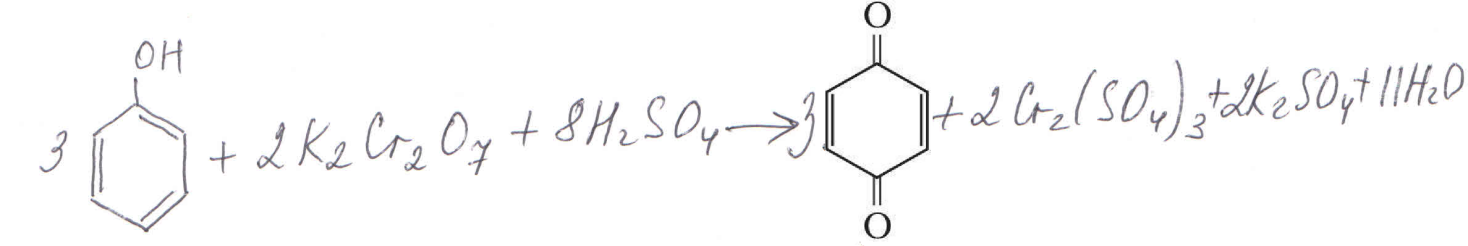

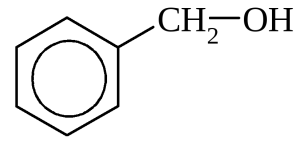 бензиловый спирт (фенилкарбинол) –
бензиловый спирт (фенилкарбинол) – фенилэтиловый спирт (бензилкарбинол)
фенилэтиловый спирт (бензилкарбинол)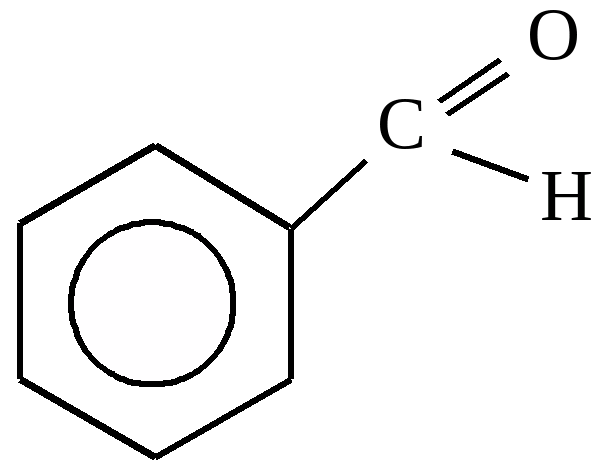 бензойный альдегид (фенилметаналь)
бензойный альдегид (фенилметаналь)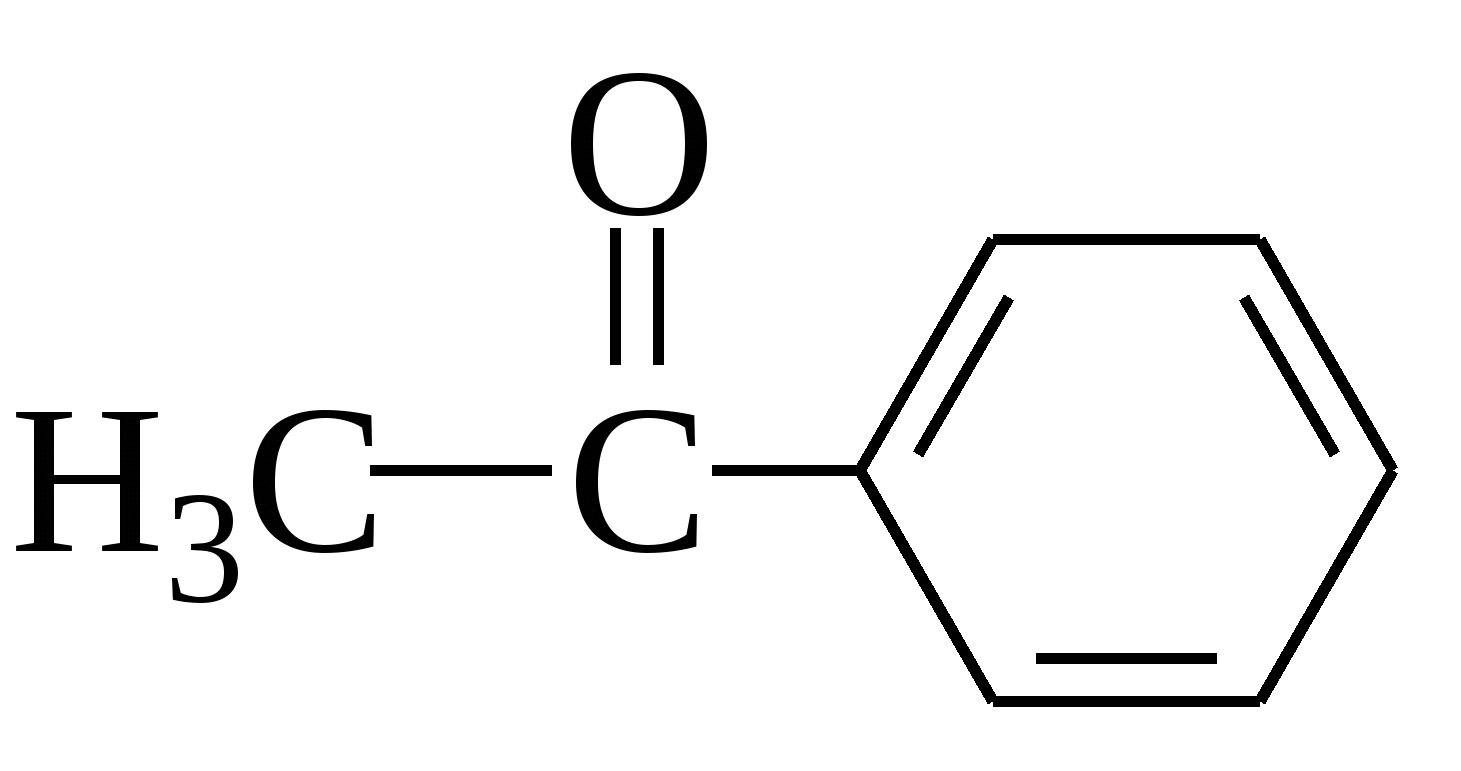 метилфенилкетон (ацетофенон)
метилфенилкетон (ацетофенон) дифенилкетон (бензофенон)
дифенилкетон (бензофенон)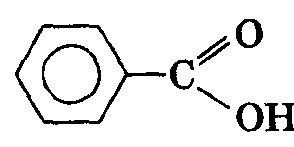 бензойная кислота
бензойная кислота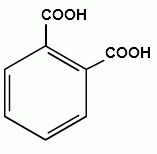 фталевая кислота (орто-фталевая кислота)
фталевая кислота (орто-фталевая кислота)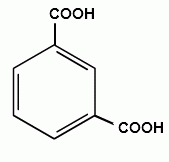 изофталевая кислота (мета-фталевая кислота)
изофталевая кислота (мета-фталевая кислота) терефталевая кислота (пара-фталевая кислота)
терефталевая кислота (пара-фталевая кислота) салициловая кислота
салициловая кислота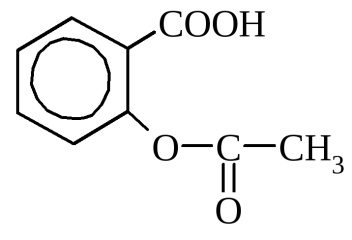 ацетилсалициловая кислота
ацетилсалициловая кислота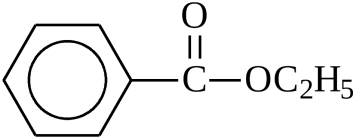 этиловый эфир бензойной кислоты, этилбензоат
этиловый эфир бензойной кислоты, этилбензоат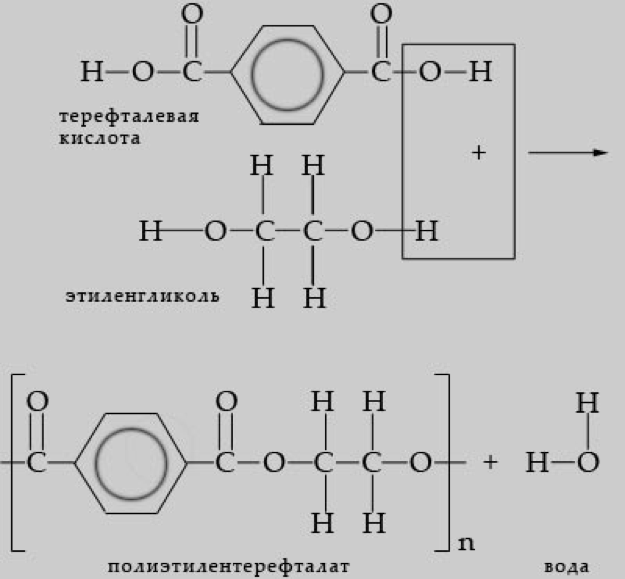
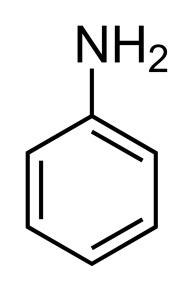 анилин
анилин