Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 25. Ароматические соединенияСтр 1 из 5Следующая ⇒
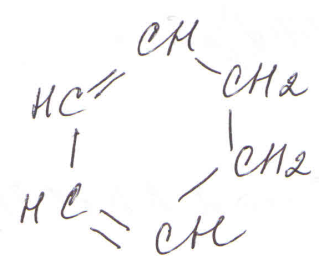
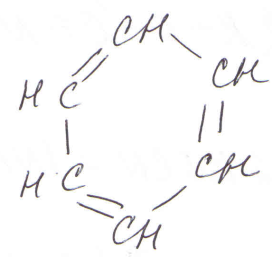
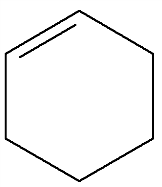
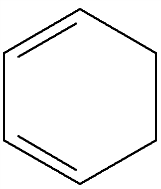
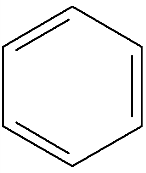
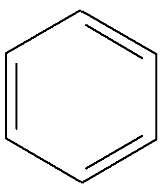
Тема 25. Ароматические соединения К ароматическим соединениям относят все соединения, содержащие бензольное кольцо (одно или несколько). Ароматические соединения, как и остальные органические соединения, классифицируют по функциональным группам. Ароматические углеводороды (арены) По строению и свойствам, ароматические углеводороды принципиально отличаются от близких внешне циклогексена и циклогексадиена:
или циклогексен циклогексадиен бензол
Напоминаю, что циклоалкены, циклоалкадиены и циклоалкины часто встречаются в цепочках (см. далее разбор задач 33). Свойства этих непредельных циклических соединений схожи со свойствами ациклических непредельных: алкенов, алкадиенов, алкинов. Тут же отметим, что формулы циклических соединений, в том числе и ароматических, предпочтительно записывать в виде геометрических фигур без указания символа углерода. Не допускается некая промежуточная форма – такая формула не будет засчитана на экзамене:
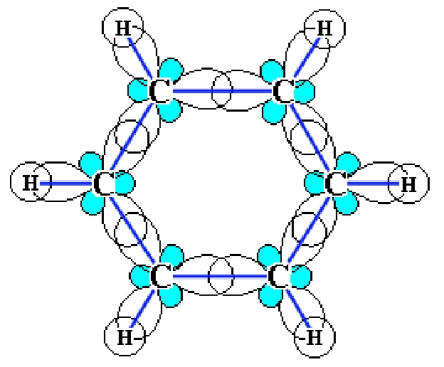
Бензольное кольцо, формально содержащее три двойные связи, отличается аномальной стабильностью. Разберем строение молекулы бензола С6Н6. Каждый атом углерода в бензоле находится в состоянии sp 2-гибридизации, каждый атом углерода образует три σ-связи (две с атомами углерода и одну – с атомом водорода). Шесть атомов углерода замкнуты в кольцо: обычно рисуют правильный шестиугольник:
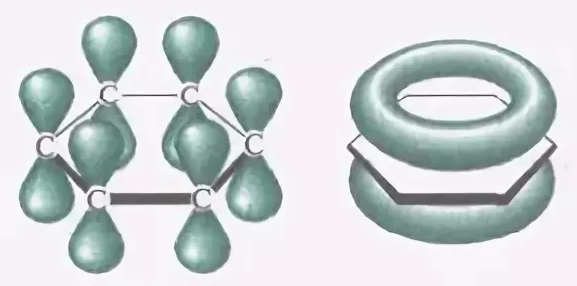
Четвертый p -электрон каждого атома не гибридизован, шесть p -орбиталей располагаются перпендикулярно плоскости кольца. Все шесть р -электронов взаимодействуют между собой, образуют единое π-электронное облако и единую химическую связь для всех атомов углерода.
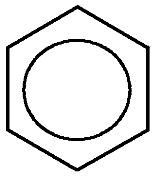
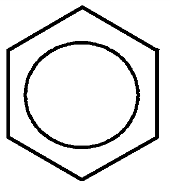
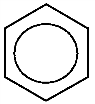
Бензол обычно обозначается или формулой Кекуле – чередованием простых и двойных связей, или шестиугольником с замкнутой линией внутри кольца.
Считается, что сам бензол правильнее обозначать Таким образом, в молекуле бензола нет чередования одинарных и двойных связей, а существует делокализованная π-электронная система, за счет которой бензольное кольцо обладает специфическими свойствами.
Бензольное кольцо чрезвычайно устойчиво, несмотря на кажущуюся ненасыщенность – С6Н6 – бензол не вступает в классические реакции присоединения по двойной связи (присоединение возможно, но в очень жестких условиях). Наиболее характерными для бензола являются реакции замещения. Галогенирование бензола. Ароматические углеводороды в обычных условиях не реагируют с галогенами (например, с бромной водой), но в присутствии катализаторов AlCl3, FeCl3, AlBr3, FeBr3 галоген легко замещает водород:
Если нужно провести реакцию с Cl2 – берут AlCl3 или FeCl3, если с Br2 – берут AlBr3, FeBr3, например:
Роль этих катализаторов – создание положительной, электрофильной частицы, например:
Cl2 + AlCl3 ® Cl+ + [AlCl4]–
Br2 + FeBr3 ® Br+ + [FeBr4]– См. опыт: https://youtu.be/kU_T16vk1LA
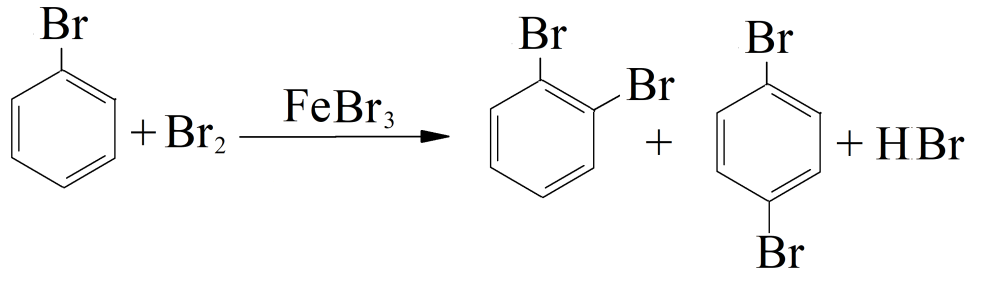
Если галоген в избытке, может быть замещен следующий водород. Здесь уже не безразлично, какой из атомов водорода будет замещен: нужно вспомнить правила ориентации (замещения) в бензольном кольце: так как галогены относятся к заместителям I рода, второй галоген размещается в орто- или пара-положении, образуется смесь продуктов:
Нитрование. При действии на бензол нитрующей смесью: смесью концентрированной азотной и концентрированной серной кислоты при нагревании, водород кольца замещается на нитрогруппу:
См. опыт: https://youtu.be/WgrVnZSv4n0
Толуол нитруется легче, сразу образуется трехзамещенное производное – 2,4,6-тринитротолуол (он же 1-метил-2,4,6-тринитробензол, тротил, тол):
1-метил-2,4,6-тринитробензол 2,4,6-тринитротолуол тротил, тол Сульфирование. При нагревании с олеумом бензол образует сульфопроизводное:
бензолсульфокислота сульфобензол
4) Реакции Фриделя — Крафтса. Это реакции алкилирования и ацилирования ароматических соединений в присутствии катализаторов AlCl3, FeCl3, FeBr3, BF3, ZnCl2 (роль катализаторов – образование электрофильной частицы). Алкилирование бензола – замещение водорода в бензольном кольце на углеводородный радикал – способ получения гомологов бензола. Алкилирование можно провести:
а) галогеналканами:
Например:
б) алкенами (в кислой среде):
в) спиртами (в присутствии концентрированной серной кислоты):
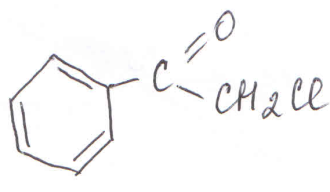
Ацилирование бензола – замещение водорода в бензольном кольце на т.н. ацильный остаток Рассмотрим на примере получения ароматического кетона ацетофенона:
ацетофенон метилфенилкетон Производное ацетофенона – хлорацетофенон:
является слезоточивым веществом (компонент газа «Черемуха»).
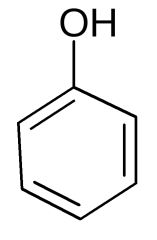
Фенолы Фенолы – это производные ароматических углеводородов, молекулы которых содержат одну или несколько гидроксильных групп –ОН, непосредственно соединенных с бензольным кольцом. Самым популярным представителем этого класса является сам фенол (гидроксибензол), устаревшее название фенола – карболовая кислота:
см. видео https://youtu.be/0hRmepJwxT0?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
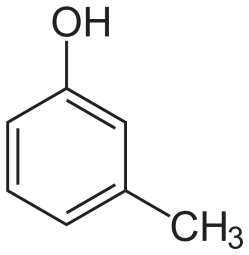
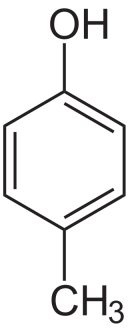
Также одноатомными (содержащие одну группу –ОН), являются крезолы:
2-метилфенол 3-метилфенол 4-метилфенол (орто-крезол) (мета-крезол) (пара-крезол)
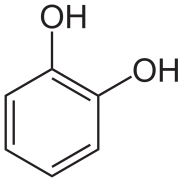
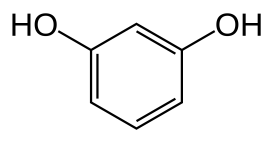
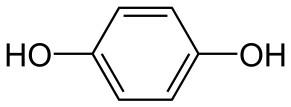
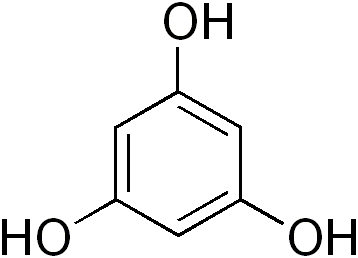
Общая формула одноатомных фенолов С n H2 n –6О или С n H2 n –7ОН. Существуют двух- и трехатомные фенолы, например (названия запоминать не нужно):
пирокатехин резорцин гидрохинон флороглюцинол (1,2-, 1,3- и 1,4-дигидроксибензолы) (1,3,5-тригидроксибензол)
Химические свойства фенолов будем разбирать на примере простейшего представителя – фенола. Химические свойства фенола и отличие свойств фенола от спиртов – популярнейшее задание ЕГЭ.
Химические свойства фенола
III Реакции окисления. 1) Горение фенола:
2) Даже на воздухе фенол окисляется – при хранении белые кристаллы фенола окрашиваются в розовый цвет, под действием сильных окислителей фенол полностью переходит в хиноны:
Двухатомные фенолы еще легче окисляются и также переходят в хиноны:
парабензохинон
Ароматические спирты
Ароматические спирты – это соединения, в которых гидроксильная группа находится в боковой цепи, то есть, не связана непосредственно с бензольным ядром, например:
простейший ароматический спирт
По способам получения и химическим свойствам ароматические спирты похожи на алифатические. Ароматические кислоты Ароматические кислоты – производные ароматических углеводородов, у которых в бензольном ядре один или несколько атомов водорода замещены карбоксильными группами. Наличие бензольного ядра увеличивает кислотные свойства: они сильнее алифатических. Надо знать простейшую ароматическую кислоту – бензойную:
Также в ЕГЭ встречаются изомерные двухосновные фталевые кислоты:
(1,2-бензолдикарбоновая кислота)
(1,3-бензолдикарбоновая кислота)
(1,2-бензолдикарбоновая кислота)
Большое значение имеют и гетерофункциональные соединения, содержащие карбоксильную группу:
(2-гидроксибензойная кислота)
(эфиры салициловой кислоты по ОН-группе)
Ароматические кислоты образуют сложные эфиры, например:
Терефталевая кислота и ее эфиры – основа многих полимеров. Например, при поликонденсации терефтелевой кислоты с этиленгликолем
образуется полиэтиленгликольтерефталат (обычно его называют полиэтилентерефталат, ПЭТ), в России этот полимер называют лавсан по аббревиатуре ЛАборатории Высокомолекулярных Соединений Академии Наук, где он был получен в 1949 г. Этот полимер используется для производства пластиковых бутылок, прозрачных прочных нитей, волокон.
Ароматические амины
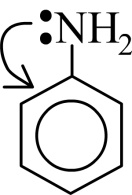
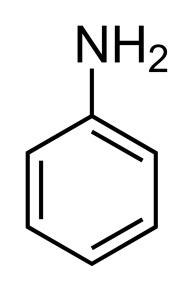
Рассмотрим только простейший ароматический амин – аминобензол или анилин:
Анилин – маслянистая жидкость с резким запахом, малорастворимая в воде. см. видео https://youtu.be/BdP9Xgbe0xg?list=PLnbQh4j9gZkKZDdTU1xVdJZ8FQIvkJCWF
Особенность анилина – взаимное влияние аминогруппы и бензольного кольца. Главное отличие анилина от аминов предельного ряда – неподеленная электронная пара азота вовлекается в бензольное кольцо:
поэтому азот анилина, в отличии азота аммиака и аминов, в меньшей степени способен образовывать донорно-акцепторные связи с Н+. Анилин более слабое основание, чем предельные амины и аммиак, его раствор не обнаруживает щелочную реакцию. Анилин не реагирует с водой (не образует гидроксидов) и не изменяет окраску индикаторов.
см. опыт https://youtu.be/8vsB95fs6Ls
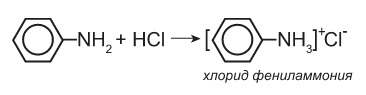
Анилин способен реагировать только с сильными кислотами (соляной, серной) образуя соли фениламмония
см. опыт https://youtu.be/NjmJ8YLRoxI
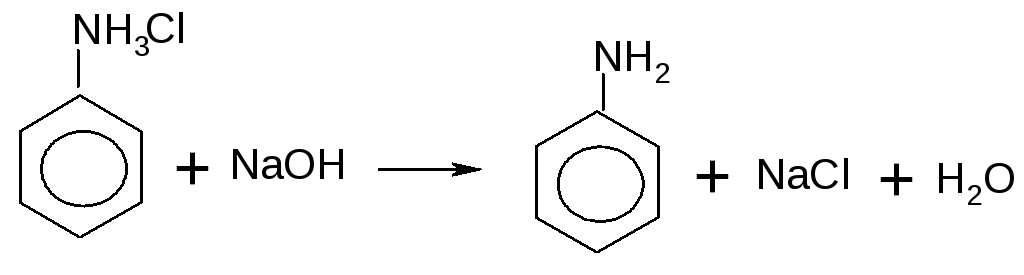
Как соли слабого основания, соли фениламмония реагируют со щелочами с образованием анилина:
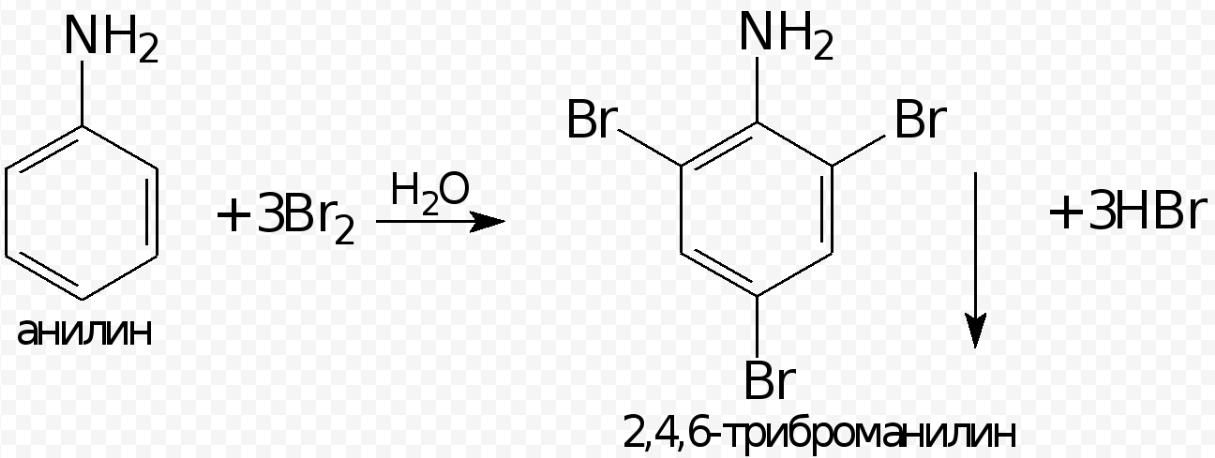
Главное отличие анилина от ароматических углеводородов – анилин обесцвечивает бромную воду. Так как аминогруппа является заместителем I рода и облегчает реакции замещения в бензольном ядре, анилин реагирует с бромной водой с образованием белого осадка 2,4,6-триброманилина:
см. опыт https://youtu.be/3Kc76xYuetc
В отличие от аминов алифатического ряда, анилин легко окисляется, даже на воздухе он темнеет. Сильными окислителями анилин окисляется до различных хинонов от фиолетового до черного цвета. Например, при взаимодействии анилина с K2Cr2O7 образуется краситель «анилиновый черный». Анилин используется в производстве красителей и лекарств.
см. опыты https://youtu.be/od3PMioRfRI https://youtu.be/WHAVBS-k5zs
Тема 25. Ароматические соединения К ароматическим соединениям относят все соединения, содержащие бензольное кольцо (одно или несколько). Ароматические соединения, как и остальные органические соединения, классифицируют по функциональным группам.
|
||||||||
|
Последнее изменение этой страницы: 2021-04-04; просмотров: 282; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.132.214 (0.063 с.) |
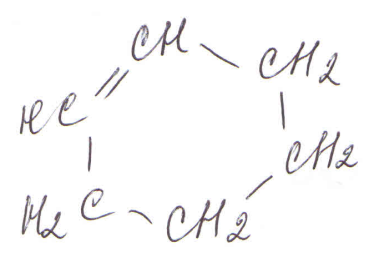
 ,
, 
 или
или 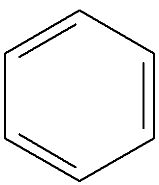
 но гомологи и производные бензола – формулой Кекуле
но гомологи и производные бензола – формулой Кекуле 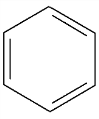 , так как заместители нарушают симметрию делокализованного π-электронного облака.
, так как заместители нарушают симметрию делокализованного π-электронного облака.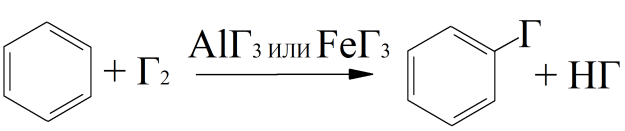
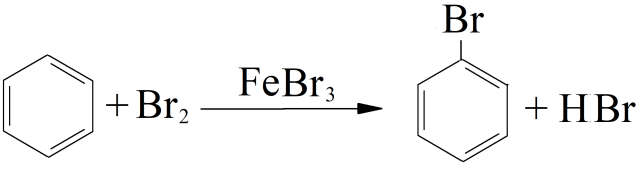
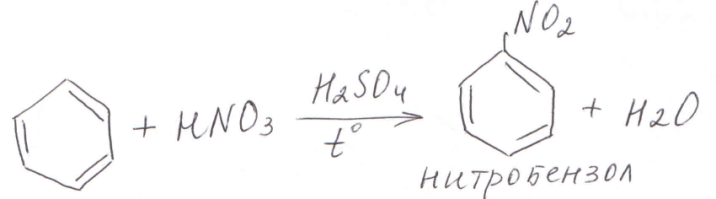
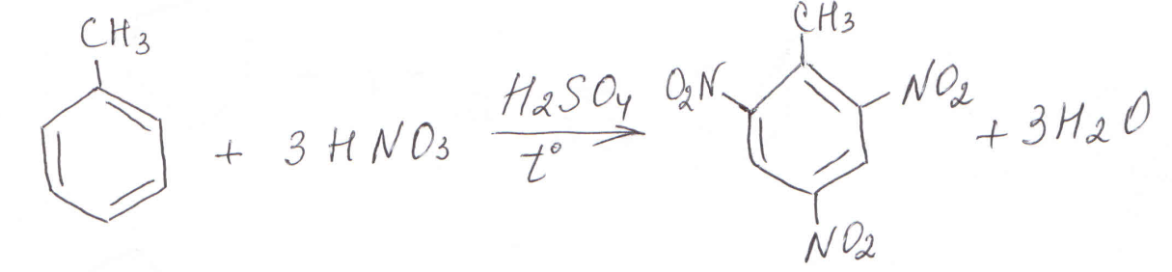
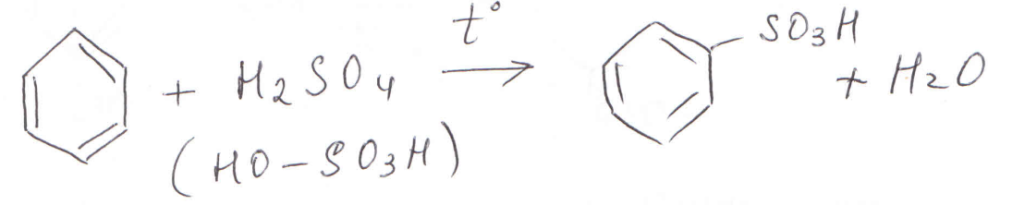
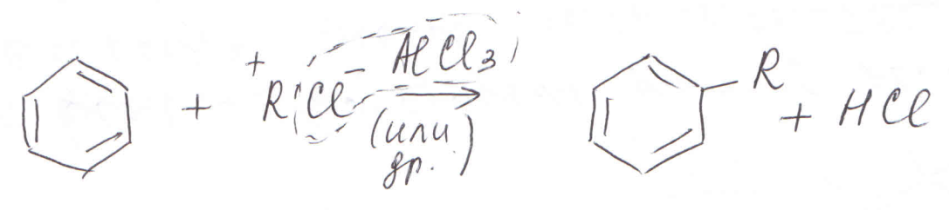


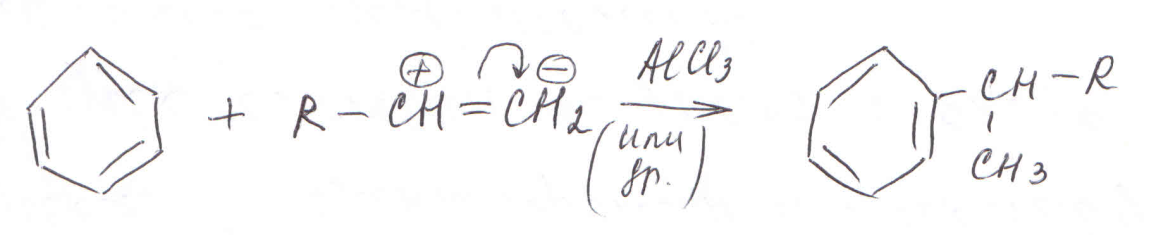
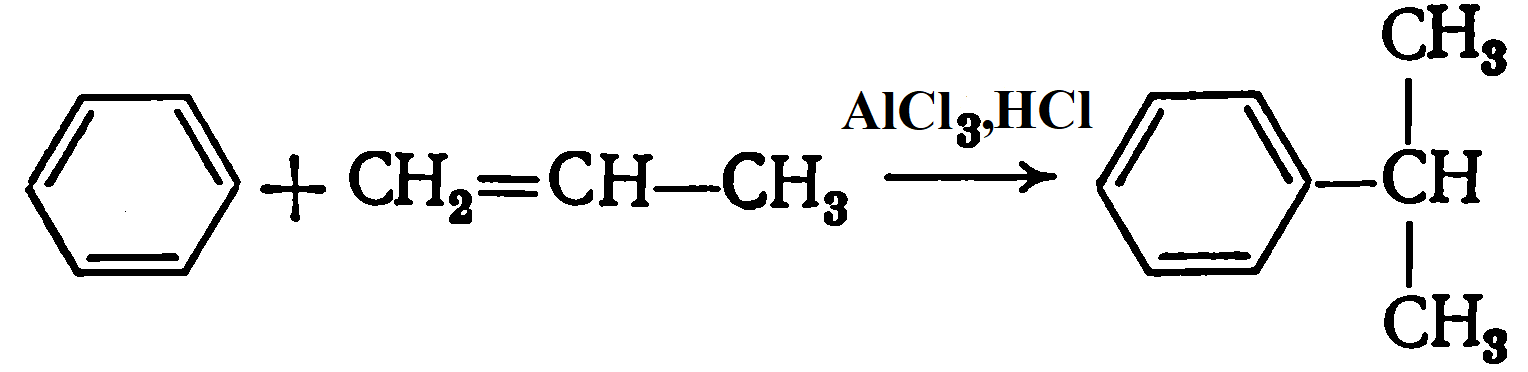
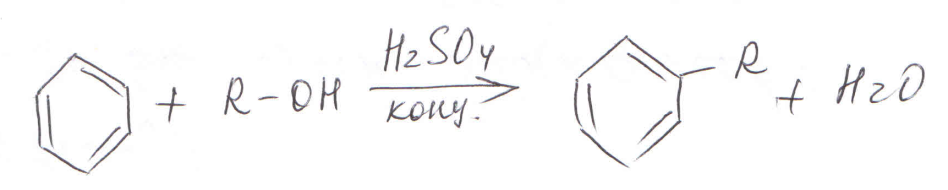
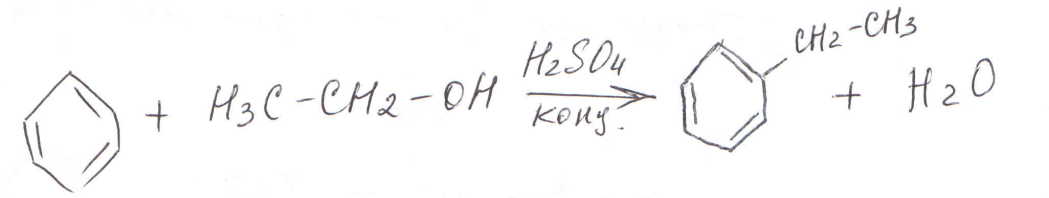
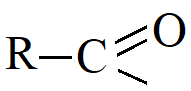 . Например, введение остатка уксусной кислоты
. Например, введение остатка уксусной кислоты 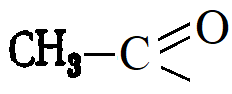 называется ацетилированием. В качестве ацилирующих агентов используют галогенангидриды и ангидриды кислот.
называется ацетилированием. В качестве ацилирующих агентов используют галогенангидриды и ангидриды кислот.
 гидроксибензол / фенол / карболовая кислота
гидроксибензол / фенол / карболовая кислота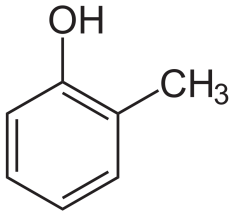

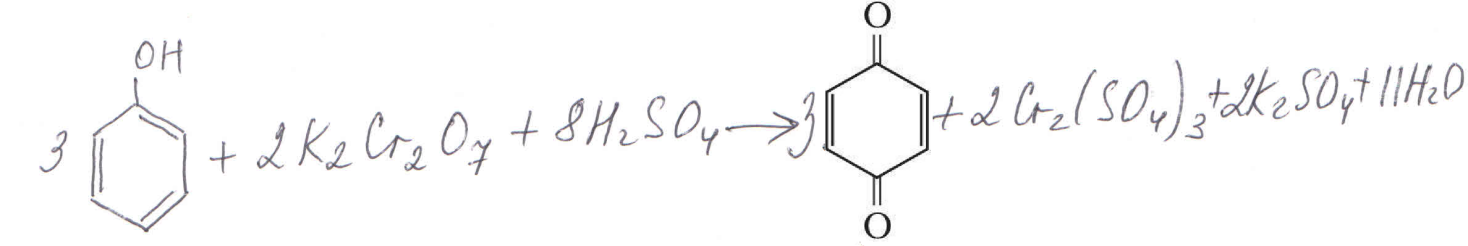

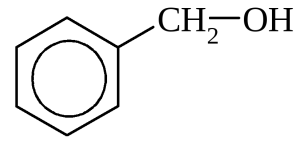 бензиловый спирт (фенилкарбинол) –
бензиловый спирт (фенилкарбинол) – фенилэтиловый спирт (бензилкарбинол)
фенилэтиловый спирт (бензилкарбинол)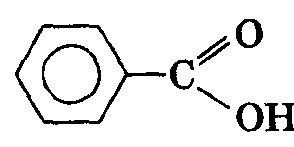 бензойная кислота
бензойная кислота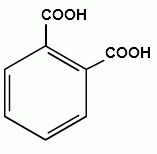 фталевая кислота (орто-фталевая кислота)
фталевая кислота (орто-фталевая кислота)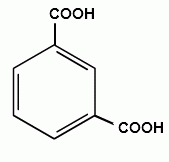 изофталевая кислота (мета-фталевая кислота)
изофталевая кислота (мета-фталевая кислота) терефталевая кислота (пара-фталевая кислота)
терефталевая кислота (пара-фталевая кислота) салициловая кислота
салициловая кислота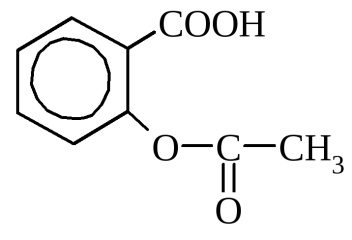 ацетилсалициловая кислота
ацетилсалициловая кислота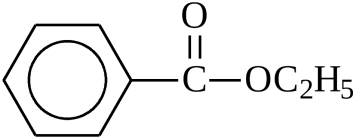 этиловый эфир бензойной кислоты, этилбензоат
этиловый эфир бензойной кислоты, этилбензоат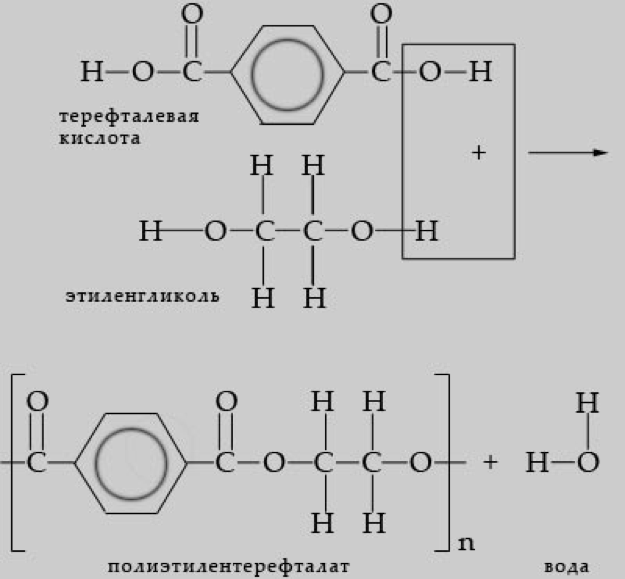
 анилин
анилин