
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Прямая потенциометрия (ионометрия)
Метод прямой потенциометрии основан на непосредственном измерении в анализируемом растворе потенциала индикаторного электрода по отношению к потенциалу электрода сравнения и нахождении концентрации (или активности) определяемого иона в соответствии с уравнением Нернста. Поскольку концентрация ионов во внутреннем растворе ИСЭ постоянна и потенциал электрода определяется только концентрацией анализируемого иона в растворе, то уравнение можно записать в следующем виде
где n – заряд определяемого иона, а – активность, С – концентрация, моль/л, рС = – lgC – показатель концентрации. Для катионов в уравнении знак (–), для анионов – (+). Из этого выражения видно, что зависимость потенциала индикаторного электрода от величины рС имеет линейный характер и соответствует уравнению вида y = а + bx, где х = – lgC = рС. Количественное определение ионов проводят методом градуировочного графика, а также методом ограничивающих растворов. Вид градуировочного графика Е – f (рС) для ионоселективного электрода приведен на рисунке 2.1.
Рисунок 2.1 – Градуировочный график для ионоселективного электрода
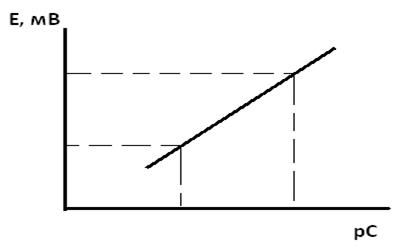
Установка для ионометрии и методика измерений Установка для прямой потенциометрии (рисунок 2.2) включает электролитическую ячейку с анализируемым раствором (2), в которую опущены индикаторный электрод (3) и электрод сравнения (4), потенциометр (5) и магнитную мешалку (1). Потенциометры (рН-метр-милливольтметр или иономер) предназначены для измерения ЭДС электродной системы.
а б Рисунок 2.2 – Схема (а) и внешний вид (б) установки для ионометрии (потенциометр - рН-метр-иономер «Эксперт-001»)
В ионометрии используют ионоселективные электроды, на поверхности которых протекают реакции обмена между ионами, находящимися в растворе, и ионами, находящимися в мембране. Селективность электрода к определенному иону зависит от типа и свойств мембраны. Основными достоинствами ИСЭ являются высокая избирательность, которая позволяет определять селективно какой-либо ион в присутствии избытка посторонних ионов, т. е. без предварительного разделения.
Методика измерений ЭДС (мВ) на универсальном иономере ЭВ-74 При работе с иономером ЭВ-74 можно пользоваться только теми ручками переключателей, которые указаны ниже. Для подготовки установки к работе и проведению измерений студенты выполняют следующие операции: 1. Перед началом работы проверяют заземление иономера и магнитной мешалки. 2. Включают индикаторный электрод (измерительный) и электрод сравнения (вспомогательный) в гнезда прибора на задней панели в соответствии с маркировкой. 3. Включают прибор тумблером на передней панели в сеть и прогревают его 30 мин. 4. Устанавливают в исходное положение переключатели иономера. Для этого на панели прибора нажимают клавишу «mV» и клавишу нижней шкалы прибора «–1…19». Клавиша «анионы/катионы (+/–)» при измерении положительных значений потенциала должна быть отжата, а отрицательных значений – нажата. 5. Промывают электроды дистиллированной водой, осушают полосками фильтровальной бумаги и погружают в анализируемый раствор. 6. Когда стрелка прибора остановится (изменение потенциала не должно превышать 2-3 мВ в течение 1 мин.), определяют показания иономера в милливольтах. Отсчет показаний. Иономер ЭВ-74 имеет три шкалы измерений: нижнюю (грубую) «–1…19» на 2000 мВ с ценой деления 50 мВ и две верхние (узкие) «0…5» и «–1…4» на 500 мВ с ценой деления 5 мВ. Первоначально проводят ориентировочное измерение ЭДС по нижней шкале «–1…19». На основании результатов этого измерения выбирают узкий диапазон измерения нажатием соответствующей клавиши («–1…4», «4…9». «9…14» и «14…19») и снимают показания на верхней шкале прибора. Показания, отсчитанные на любом диапазоне измерения, следует умножить на 100. Если стрелка прибора при работе на диапазоне «–1…4» или «–1…19» уходит влево за пределы шкалы, необходимо переключить клавишу «анионы/катионы (+/–)»; если стрелка прибора уходит за пределы шкалы при работе на других диапазонах, необходимо переключить диапазон измерений. Пример 1. По нижней шкале стрелка установилась на значении 5,2. Следовательно, ориентировочно потенциал составляет 5,2 х 100 = 520 мВ. Для нахождения более точного значения измерения величины нажимают клавишу «4…9». При этом стрелка по верхней шкале прибора «0…5» установилась на значении 1,25. Измеряемая величина составляет 4 + 1,25 = 5,25, т.е. 5,25 х 100 = 525 мВ.
Пример 2. По нижней шкале прибора стрелка установилась на значении –0,3. Следовательно, ориентировочное значение потенциала составляет –0,3 х 100 = –30 мВ. Для нахождения более точного значения измерения величины нажимают клавишу «–1…4». При этом стрелка по верхней шкале прибора установилась на значении –0,35. Измеряемая величина равна –0,35 х 100 = = –35 мВ.
Методика измерений ЭДС (мВ) на рН-метре-иономере «Эксперт-001» При работе с рН-метром-иономером «Эсперт-001» можно пользоваться только теми кнопками прибора, которые указаны ниже. Для подготовки установки к работе и проведению измерений студенты выполняют следующие операции: 1. Включают в розетку измерительный прибор «Эксперт-001». 2. Подключают индикаторный электрод (измерительный) к разъему «ИЗМ», электрод сравнения (вспомогательный) – к разъему «ВСП». 3. Опускают электроды в стакан с анализируемым раствором. 4. Включают прибор, нажав кнопку «ВКЛ». На дисплее появится надпись: Выбор режима
5. Нажимают кнопку «ИОН» и кнопками «|>» и «<|» выбирают необходимый ион из введенных в память прибора, например К+. На дисплее появится надпись: К…… Заряд + М.М 6. Нажимают кнопку «ВВОД», при этом вернется режим «рН-метр-иономер». 7. Нажимают кнопку «ИЗМ». На дисплее появятся результаты измерения ЭДС: ххх,х мВ. 8. Нажимают кнопку «ОТКЛ» для выхода из режима измерения.
2.1.2. Исследование условий определения методом ионометрии Для определения компонентов технологических растворов, сточных и природных вод необходимо провести определенные исследования. При работе с ИСЭ проводят калибровку электрода – устанавливают зависимость между потенциалом электрода и концентрацией определяемого иона. Для этого выполняют измерения потенциала в серии стандартных растворов. Стандартные растворы чаще всего готовят путем последовательного десятикратного разбавления исходного стандартного раствора дистиллированной водой. Полученные экспериментальные данные используют для построения градуировочного графика Е = f (pС), по которому устанавливают следующие электрохимические характеристики ИСЭ: 1. Нернстовская область электродной функции – интервал концентраций, в котором соблюдается прямолинейная зависимость Е = f (pС); 2. Крутизна электродной функции – угловой коэффициент наклона градуировочного графика; находят как тангенс угла наклона прямой и сравнивают с теоретическим значением. Согласно уравнению Нернста для однозарядных ионов он равен 59 мВ/ед. рС Затем проверяют стабильность градуировочного графика во времени, проводя повторные измерения через несколько дней, и определяют время отклика электрода, т.е. время установления постоянного значения потенциала после помещения ИСЭ в раствор. Если в растворе присутствуют ионы, которые могут мешать определению, необходимо проверить их влияние на градуировочную зависимость. Для этого приготавливают фоновый раствор, содержащий все компоненты анализируемого раствора, кроме определяемого иона. Затем готовят стандартные растворы, используя при разбавлении фоновый раствор. На этом фоне проверяют и строят градуировочную зависимость.
|
||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 1227; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.239.148 (0.007 с.) |
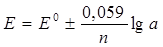
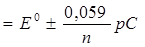 ,
,

 рН-метр-иономер
рН-метр-иономер


