
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гридина Н.Н., Новиков А.В., Баранов О.В.Стр 1 из 10Следующая ⇒
МИНИСТЕРСТВО ОБРАЗОВАНИя И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ДИЗАЙНА И ТЕХНОЛОГИИ» (ФГБОУ ВПО «МГУДТ»)
Гридина Н.Н., Новиков А.В., Баранов О.В.
ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. Часть 1. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Учебное пособие Допущено к изданию редакционно-издательским советом университета в качестве учебного пособия для подготовки бакалавров по направлению 18.03.01(240100) Химическая технология, 29.03.03(261700) Технология полиграфического и упаковочного производства, 20.03.01(280700) Техносферная безопасность
Москва МГУДТ 2015
УДК 543.55(075) Г 83
Г 83 Гридина Н.Н., Новиков А.В., Баранов О.В. Физико-химические методы анализа. Часть 1. Электрохимические методы анализа: учебное пособие – М.:МГУДТ, 2015. - 68с.
Рецензенты: - доцент кафедры аналитической химии Российского химико-технологического университета им. Д.И. Менделеева (РХТУ), к.х.н. доц. Ермоленко Ю.В. - доцент кафедры ТХВ и Н ФГБОУ ВПО «МГУДТ», к.х.н., доц. Редина Л.В.
В учебном пособии «ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА. Часть 1. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА» кратко рассмотрены теоретические вопросы по основным разделам электрохимии (потенциометрии, вольтамперометрии, кулонометрии), приведены описание установок и методики выполнения лабораторных работ. Даны рекомендации для выполнения учебно-исследовательских заданий при прохождении лабораторного практикума, а также по обработке и представлению полученных результатов количественных определений. Учебное пособие предназначено для обучающихся по направлениям подготовки 18.03.01(240100) Химическая технология, 29.03.03(261700) Технология полиграфического и упаковочного производства и 20.03.01(280700) Техносферная безопасность всех форм обучения и будет использовано при изучении дисциплин «Физико-химические методы анализа» и «Методы и приборы контроля загрязнений окружающей среды».
УДК 543.55(075)
Подготовлено к печати на кафедре физической и коллоидной химии
Печатается в авторской редакции.
СОДЕРЖАНИЕ
| ||||||||||
| Введение……………………………………………………………………… | 5 | ||||||||||
| 1. | МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ, ОБРАБОТКА И ПРЕДСТАВЛЕНИЕ РЕЗУЛЬТАТОВ АНАЛИЗА……………………….. | 6 | |||||||||
| 1.1. Прямые методы…………………………………………………………. | 6 | ||||||||||
| 1.2. Методы титрования…………………………………………………….. | 10 | ||||||||||
| 1.3. Математическая обработка результатов анализа……………………... | 11 | ||||||||||
| 2. | ПОТЕНЦИОМЕТРИЧЕСКИЕ МЕТОДЫ………………………………….. | 13 | |||||||||
| 2.1. Прямая потенциометрия (ионометрия)………………………………... | 14 | ||||||||||
| 2.1.1. Установка для ионометрии и методика измерений………………… | 15 | ||||||||||
| 2.1.2. Исследование условий определения методом ионометрии………... | 17 | ||||||||||
| 2.1.3. Определение ионов в технологических растворах, природных и сточных водах………………………………………………………………... | 18 | ||||||||||
| Работа 1. Определение рН растворов………………………………. | 18 | ||||||||||
| Работа 2. Определение катионов и анионов в водах……………… | 21 | ||||||||||
| 2.2. Потенциометрическое титрование…………………………………….. | 24 | ||||||||||
| 2.2.1. Установка для потенциометрического титрования и методика измерений……………………………………………………………………. | 25 | ||||||||||
| 2.2.2. Исследование условий определения методом потенциометрического титрования………………………………………… | 26 | ||||||||||
| 2.2.3. Определение компонентов технологических растворов, природных и сточных вод…………………………………………………... | 28 | ||||||||||
| Работа 1. Определение содержания HCl в растворе………………. | 30 | ||||||||||
| Работа 2. Определение содержания хлорида натрия в растворе…. | 31 | ||||||||||
| Работа 3. Определение H2O2 в растворе……………………………. | 32 | ||||||||||
| Работа 4. Определение дихромата калия в растворе……………… | 33 | ||||||||||
| 2.3. Контрольные вопросы………………………………………………….. | 36 | ||||||||||
| 3. | МЕТОДЫ ПОЛЯРОГРАФИИ………………………………………………. | 36 | |||||||||
| 3.1. Установка для полярографических определений…………………….. | 38 | ||||||||||
| 3.2. Методика выполнения анализа………………………………………… | 39 | ||||||||||
| 3.3. Исследование условий определения методом полярографии……….. | 42 | ||||||||||
| 3.4. Определение компонентов технологических растворов, природных и сточных вод..……………………………………………………………...... | 42 | ||||||||||
| Работа 1. Определение концентрации ионов цинка в сточных водах производства вискозного волокна…………………………………... | 43 | ||||||||||
| Работа 2. Определение концентрации формальдегида в водах производства химических волокон и отделочного производства………… | 45 | ||||||||||
| Работа 3. Определение концентрации ионов железа в растворителе производства волокна из поливинилхлорида……………… | 48 | ||||||||||
| Работа 4. Определение концентрации ионов Li+ в сточных водах производства волокна из ароматического полиамида…………………….. | 50 | ||||||||||
| 3.5. Контрольные вопросы………………………………………………….. | 52 | ||||||||||
| 4. | АМПЕРОМЕТРИЧЕСКОЕ ТИТРОВАНИЕ……………………………… | 52 | |||||||||
| 4.1. Установка для амперометрического титрования и методика измерений……………………………………………………………………. | 53 | ||||||||||
| 4.2. Исследование условий определения методом амперометрического титрования……………………………………………………………………. | 54 | ||||||||||
| 4.3. Определение металлов в технологических растворах и водах………. | 54 | ||||||||||
| Работа 1. Определение концентрации ионов цинка в технологических растворах производства вискозного волокна………….. | 54 | ||||||||||
| Работа 2. Определение концентрации ионов меди в технологических растворах………………………………………………… | 57 | ||||||||||
| 4.4. Контрольные вопросы…………………………………………………... | 59 | ||||||||||
| 5. | КУЛОНОМЕТРИЧЕСКИЕ МЕТОДЫ……………………………………... | 60 | |||||||||
| 5.1. Установка для кулонометрического титрования……………………... | 61 | ||||||||||
| 5.2. Определение компонентов технологических растворов и сточных вод…………………………………………………………………………….. | 62 | ||||||||||
| Работа 1. Определение примесей кислот в технологических растворах и водах………….……………………………………………….. | 62 | ||||||||||
| Работа 2. Определение воды в неводных растворах производства синтетических волокон……………………………………………………… | 64 | ||||||||||
| 5.3. Контрольные вопросы………………………………………………….. | 65 | ||||||||||
| Литература……………………………………………………………………. | 66 | ||||||||||
| Приложение…………………………………………………………………... | 67 | ||||||||||
|
|
ВВЕДЕНИЕ
Настоящее пособие предназначено для студентов, выполняющих лабораторный практикум по физическим и физико-химическим методам анализа (ФХМА), которые широко используют в химико-аналитическом контроле технологических процессов и загрязнений окружающей среды.
В пособие включены практические работы по основным электрохимическим методам анализа: потенциометрии, полярографии, амперометрическому титрованию, кулонометрии и рекомендации по их выполнению. В каждом разделе изложены краткие теоретические положения, приведены схемы установок и методики работы на них для получения результатов количественных определений, последовательность выполнения работ данным методом. Описание работ представлено таким образом, чтобы студент мог выполнить учебно-исследовательскую работу (УИР) по выбору условий определения компонентов в предложенном объекте анализа, составить методику определения, а также использовать предложенный метод для анализа не только описанных в пособии объектов, но и других объектов.
|
|
Информация первого раздела практикума: приемы количественных определений, которые используют при проведении анализа, правила построения градуировочной зависимости, рекомендации по математической обработке результатов анализа, их оценке и правильности представления необходима при выполнении всех лабораторных работ.
Материал пособия позволяет студентам самостоятельно подготовиться к выполнению лабораторных работ, правильно оформить и представить результаты эксперимента; контрольные вопросы – проверить свой уровень понимания и освоения изучаемого электрохимического метода анализа.
Перед выполнением практической работы студент в лабораторном журнале самостоятельно должен сделать конспект. Он включает название и цель работы, краткие теоретические основы метода, (на чем основан метод, какая измеряемая величина является аналитическим сигналом и как он связан с концентрацией определяемого компонента), уравнения протекающих реакций. Далее надо зарисовать схему установки и записать названия отдельных ее узлов, приборов и электродов. Методику измерений на приборе в журнал переписывать не следует. Привести последовательность выполнения этапов работы.
При выполнении работы все результаты измерений и расчетов концентраций записывают в подготовленные таблицы, указанные в пособии. Построение градуировочных графиков, кривых титрования выполняют на миллиметровой бумаге. Для каждого этапа работы записывают методику выполнения и формулы для расчетов.
С целью оценки воспроизводимости и правильности результатов анализа каждая лабораторная работа заканчивается математической обработкой результатов определения.
МЕТОДЫ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ, ОБРАБОТКА И ПРЕДСТАВЛЕНИЕ РЕЗУЛЬТАТОВ АНАЛИЗА
Определение количества вещества в анализируемом растворе проводят на основе измерения аналитического сигнала. Аналитический сигнал (Ас) – это измеряемая физическая величина, которая функционально, то есть определённым уравнением, связана с концентрацией, функцией концентрации или массой определяемого компонента. Это может быть сила тока, количество электричества, ЭДС системы, оптическая плотность и т.д. Функциональная зависимость Ас = f (С) устанавливается опытным или расчетным путем или основана на физических законах.
|
|
Методы выполнения анализа бывают прямыми и косвенными. Прямые методы основаны на непосредственном измерении аналитического сигнала и использовании его зависимости от концентрации определяемого компонента. Зависимость Ас = f (С) имеет линейный характер и может быть представлена в виде формулы или графика. В косвенных методах измеряют изменение какого-либо свойства раствора в процессе титрования. По кривым титрования находят объем титранта в точке эквивалентности и рассчитывают концентрацию определяемого компонента на основе закона эквивалентности.
Во всех титриметрических методах аналитическим сигналом является объем титранта в точке эквивалентности, так как он функционально связан с концентрацией определяемого компонента.
Прямые методы
Для расчета концентрации определяемого компонента на основе измерения аналитического сигнала используют следующие прямые методы: метод градуировочного графика, метод стандарта, метод ограничивающих растворов и метод добавок.
Метод стандартов
Метод стандартов – это расчётный приём нахождения неизвестной концентрации. Он имеет две разновидности.
Метод одного стандарта. Для проведения анализа готовят один стандартный раствор с концентрацией определяемого вещества Сст. Затем измеряют величины аналитического сигнала этого раствора ( I ст) и анализируемой пробы (Ix) в одинаковых условиях.
Исходя из того, что Ix = kCx и I ст = kC ст, получаем:
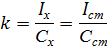
Из выражения для k выводим формулу для расчёта неизвестной концентрации:
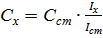 .
.
Метод двух стандартов (ограничивающих растворов)
Метод ограничивающих растворов используют в том случае, если концентрация определяемого компонента в анализируемом растворе приблизительно известна и попадает в интервал линейной зависимости показаний прибора (аналитический сигнал) от концентрации. Этим методом пользуются после установления линейности градуировочного графика в определенном диапазоне концентраций.
Готовят два стандартных раствора, близких по концентрации к анализируемому раствору 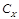 , в одном из которых концентрация определяемого компонента С 1 меньше, а в другом С 2 больше, чем в анализируемом растворе, то есть С1 < С x < C2 . Последовательно измеряют аналитический сигнал в растворах с концентрацией от меньшей к большей, снимая соответственно показания прибора I 1, Ix, I 2.
, в одном из которых концентрация определяемого компонента С 1 меньше, а в другом С 2 больше, чем в анализируемом растворе, то есть С1 < С x < C2 . Последовательно измеряют аналитический сигнал в растворах с концентрацией от меньшей к большей, снимая соответственно показания прибора I 1, Ix, I 2.
Рассчитывают концентрацию определяемого компонента по формуле
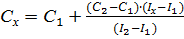 .
.
Метод добавок
Метод добавок (расчетный и графический) используют в том случае, если известно, что градуировочный график представляет собой прямую линию, выходящую из начала координат. Определение методом добавок заключается в том, что измеряют аналитический сигнал сначала в пробе анализируемого раствора (Iх), а затем к этой пробе добавляют определенное количество стандартного раствора определяемого компонента (добавку) и измеряют аналитический сигнал (Iх +ст). Объем добавки подбирают таким образом, чтобы аналитический сигнал увеличился приблизительно в два раза.
|
|
Метод однократной добавкиявляется расчётным. Неизвестную концентрацию рассчитывают по формуле
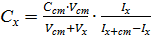 ,
,
где C ст – концентрация исходного стандартного раствора; V ст – объём стандартного раствора, добавленный к пробе; Vx – объём пробы; Ix и Ix + c т – аналитические сигналы для анализируемого раствора и анализируемого раствора с добавкой стандартного раствора.
Определение концентрации методом добавокчаще выполняют графическим способом. Для проведения анализа измеряют величины Ас в пробе анализируемого раствора и в нескольких пробах после добавления к каждой известных количеств стандартного раствора определяемого компонента. Концентрацию добавки в пробах вычисляют по формуле
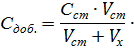
Строят график в координатах: аналитический сигнал – концентрация добавки, принимая за нуль условно концентрацию компонента в анализируемом растворе без добавки. По графику находят Сх, как абсолютную величину отрезка 0 - С х, отсекаемого прямой на оси абсцисс (рисунок 1.2).
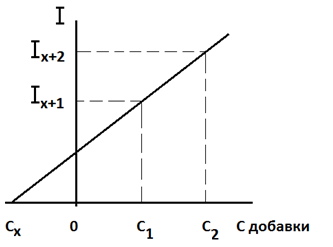
Рисунок 1.2 – Метод добавок
Метод добавок используют при анализе проб сложного состава, так как прирост аналитического сигналапри добавке стандартного раствора связан только с определяемым компонентом, а сигналы от мешающих компонентов пробы остаются постоянными [2].
Методы титрования
Титрование – процесс постепенного добавления реактива точно известной концентрации (титранта) к раствору определяемого соединения. После каждого добавления порции титранта фиксируют изменение физического свойства раствора. Это может быть предельный диффузионный ток, потенциал индикаторного электрода, оптическая плотность, электрическая проводимость. Соответственно различают амперометрическое, потенциометрическое, фотометрическое, кондуктометрическое титрование. Момент, когда титрант и определяемое соединение будут находиться в эквивалентных количествах, называют точка эквивалентности. Практически устанавливают конечную точку титрования (КТТ), близкую к точке эквивалентности.
Процесс титрования изображают графически в виде кривой титрования в координатах: измеряемое свойство раствора – объем титранта. На кривой титрования находят КТТ и соответствующий ей объем титранта, затраченный на титрование пробы анализируемого раствора. Способ нахождения КТТ на кривой титрования зависит от выбранного физико-химического метода анализа.
Определив объем титранта в конце титрования (V КТТ), рассчитывают концентрацию определяемого компонента в анализируемом растворе по закону эквивалентности:
С 1 V 1 = C 2 V 2,
где С 1и C 2– молярные концентрации эквивалента определяемого компонента и титранта, моль/л, а V 1 и V 2 – объемы пробы титруемого раствора и титранта.
1.3. Математическая обработка результатов определения
При выполнении количественного определения, как и при любом измерении, могут возникнуть погрешности двух видов: случайные и систематические. Математическая обработка результатов помогает найти наиболее вероятностное значение определяемой величины и оценить полученные результаты по воспроизводимости и правильности.
Понятие воспроизводимость результатов измерений характеризует разброс результатов определения друг относительно друга случайным образом при их повторении, и обусловлено наличием случайных погрешностей. Для оценки воспроизводимости выполняют серию повторных (параллельных) определений и рассчитывают следующие величины: стандартное отклонение S, относительное стандартное отклонение Sr, доверительный интервал δ.
Под правильностью понимают близость результата определения х к действительному значению содержания определяемого компонента а. Правильность результата характеризуется систематической погрешностью – отклонением результатов повторных определений от действительного значения на постоянную величину.
Математическую обработку результатов определения проводят методами математической статистики для малых выборок, используя следующие формулы и указанную последовательность расчетов:
1. Среднее арифметическое из всех полученных результатов
х ср= 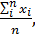
где xi - единичный результат определения; n – число повторных определений.
2. Стандартное отклонение единичного определения – мера разброса значений измеряемой величины относительно среднего
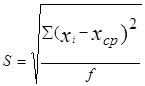 ,
,
где 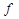 - число степеней свободы показывает число контрольных измерений, воспроизводящих первый результат. Для результатов анализа одной пробы f = n – 1.
- число степеней свободы показывает число контрольных измерений, воспроизводящих первый результат. Для результатов анализа одной пробы f = n – 1.
3. Относительное стандартное отклонение
 , %.
, %.
4. Доверительный интервал результата определения – оценка их неопределенности
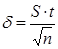 ,
,
где 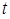 – критерий Стьюдента находят по таблице (см. приложение) в зависимости от уровня доверительной вероятности Р и числа степеней свободы f = n – 1. В аналитической практике принимают Р = 0,95; это означает, что вероятность нахождения действительного значения в пределах доверительного интервала составляет 95%.
– критерий Стьюдента находят по таблице (см. приложение) в зависимости от уровня доверительной вероятности Р и числа степеней свободы f = n – 1. В аналитической практике принимают Р = 0,95; это означает, что вероятность нахождения действительного значения в пределах доверительного интервала составляет 95%.
Доверительный интервал показывает пределы области среднего значения определяемой величины, внутри которой с вероятностью Р может находиться действительное значение содержания определяемого компонента, при отсутствии систематической погрешности:

Для оценки правильности сравнивают действительное значение а с доверительным интервалом хср ± δ. Если действительное значение а попадает в доверительный интервал, то систематическая ошибка отсутствует и результат считается правильным; погрешность обусловлена только случайными ошибками.
5. Абсолютная ошибка представляет собой разность между действительным значением и найденным значением:
Δабс. = х – α.
Относительная погрешность – отношение абсолютной ошибки к действительной величине, выраженной в процентах
Δотн. = (Хср – α) . 100/ α, %.
Результат анализа представляют в форме среднего значения из серии параллельных определений с рассчитанным доверительным интервалом:
x ср ± δ.
Подробные рекомендации и примеры по проведению и оформлению расчетов приведены в пособии [3].
Округление результата определенияx ср ± δ выполняют на последней стадии обработки результатов и начинают с округления значения погрешности δ, а не среднего значения.
Погрешность результата определения δ принято записывать одной цифрой одной или двумя значащими цифрами:
– однойцифрой, если первая цифра погрешности равна 3 или более.
– двумяцифрами, если первая из них равна 1 или 2.
Результат определения x ср должен заканчиваться цифрой того же разряда, что и последняя значащая цифра погрешности. Например, 20,5 ± 0,4; 0,2236 ± 0, 0015; 10,00 ± 0,24.
Обработанные результаты определения представляют в виде таблицы 1.1.
Таблица 1.1 - Математическая обработка результатов
| n | хср . | S | Sr, % | x ср ± δ |
2. ПОТЕНЦИОМЕТРИЧЕСКИЕ МЕТОДЫ АНАЛИЗА
Потенциометрические методы анализа основаны на измерении разности потенциалов (ЭДС) между двумя электродами, опущенными в анализируемый раствор. Один электрод является индикаторным, его потенциал зависит от концентрации (активности) определяемого иона. Потенциал другого электрода, который называется электродом сравнения, не зависит от концентрации определяемого иона и в процессе определения остается постоянным. Зависимость равновесного потенциала индикаторного электрода от активности иона в растворе описывается уравнением Нернста:
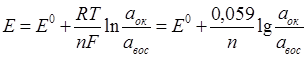
где Е – равновесный потенциал в реальных условиях, В; Е 0 – стандартный потенциал, В; n – число электронов, участвующих в электродной реакции; Т – абсолютная температура, К; R – универсальная газовая постоянная, равная 8,314 Дж/К.моль; F – число Фарадея 96500 Кл/моль; а – активность, моль/л. Активность а с концентрацией С связаны соотношением а = jC, где j – коэффициент активности. Для очень разбавленных растворов j → 1 и принимают, что активность почти равна концентрации.
В потенциометрии используют два вида индикаторных электродов.
1. Электроды, на поверхности которых или в приэлектродном слое протекают электронообменные процессы. К ним относятся инертные электроды (платиновый, золотой) и металлические электроды 1-го рода (серебряный, медный и др.).
2. Э лектроды, у которых на межфазных границах (мембрана – раствор) протекают ионообменные процессы – ионоселективные (мембранные) электроды (ИСЭ).
В качестве электрода сравнения в лабораторной практике чаще всего используют электрод 2-го рода – хлоридсеребряный.
Потенциометрические методы разделяют на две группы: методы прямой потенциометрии (ионометрия) и методы косвенной потенциометрии (потенциометрическое титрование).
Основным условием выполнения определения потенциометрическим методом является правильный выбор индикаторного электрода. В прямой потенциометрии используют ионоселективные электроды. При потенциометрическом титровании выбор индикаторного электрода зависит от природы определяемого иона и типа химической реакции при титровании.
Методика измерений ЭДС (мВ) на универсальном иономере ЭВ-74
При работе с иономером ЭВ-74 можно пользоваться только теми ручками переключателей, которые указаны ниже. Для подготовки установки к работе и проведению измерений студенты выполняют следующие операции:
1. Перед началом работы проверяют заземление иономера и магнитной мешалки.
2. Включают индикаторный электрод (измерительный) и электрод сравнения (вспомогательный) в гнезда прибора на задней панели в соответствии с маркировкой.
3. Включают прибор тумблером на передней панели в сеть и прогревают его 30 мин.
4. Устанавливают в исходное положение переключатели иономера. Для этого на панели прибора нажимают клавишу «mV» и клавишу нижней шкалы прибора «–1…19». Клавиша «анионы/катионы (+/–)» при измерении положительных значений потенциала должна быть отжата, а отрицательных значений – нажата.
5. Промывают электроды дистиллированной водой, осушают полосками фильтровальной бумаги и погружают в анализируемый раствор.
6. Когда стрелка прибора остановится (изменение потенциала не должно превышать 2-3 мВ в течение 1 мин.), определяют показания иономера в милливольтах.
Отсчет показаний. Иономер ЭВ-74 имеет три шкалы измерений: нижнюю (грубую) «–1…19» на 2000 мВ с ценой деления 50 мВ и две верхние (узкие) «0…5» и «–1…4» на 500 мВ с ценой деления 5 мВ. Первоначально проводят ориентировочное измерение ЭДС по нижней шкале «–1…19». На основании результатов этого измерения выбирают узкий диапазон измерения нажатием соответствующей клавиши («–1…4», «4…9». «9…14» и «14…19») и снимают показания на верхней шкале прибора. Показания, отсчитанные на любом диапазоне измерения, следует умножить на 100.
Если стрелка прибора при работе на диапазоне «–1…4» или «–1…19» уходит влево за пределы шкалы, необходимо переключить клавишу «анионы/катионы (+/–)»; если стрелка прибора уходит за пределы шкалы при работе на других диапазонах, необходимо переключить диапазон измерений.
Пример 1. По нижней шкале стрелка установилась на значении 5,2. Следовательно, ориентировочно потенциал составляет 5,2 х 100 = 520 мВ. Для нахождения более точного значения измерения величины нажимают клавишу «4…9». При этом стрелка по верхней шкале прибора «0…5» установилась на значении 1,25. Измеряемая величина составляет 4 + 1,25 = 5,25, т.е. 5,25 х 100 = 525 мВ.
Пример 2. По нижней шкале прибора стрелка установилась на значении –0,3. Следовательно, ориентировочное значение потенциала составляет –0,3 х 100 = –30 мВ. Для нахождения более точного значения измерения величины нажимают клавишу «–1…4». При этом стрелка по верхней шкале прибора установилась на значении –0,35. Измеряемая величина равна –0,35 х 100 = = –35 мВ.
Методика измерений ЭДС (мВ) на рН-метре-иономере «Эксперт-001»
При работе с рН-метром-иономером «Эсперт-001» можно пользоваться только теми кнопками прибора, которые указаны ниже. Для подготовки установки к работе и проведению измерений студенты выполняют следующие операции:
1. Включают в розетку измерительный прибор «Эксперт-001».
2. Подключают индикаторный электрод (измерительный) к разъему «ИЗМ», электрод сравнения (вспомогательный) – к разъему «ВСП».
3. Опускают электроды в стакан с анализируемым раствором.
4. Включают прибор, нажав кнопку «ВКЛ». На дисплее появится надпись:
Выбор режима
 рН-метр-иономер
рН-метр-иономер
5. Нажимают кнопку «ИОН» и кнопками «|>» и «<|» выбирают необходимый ион из введенных в память прибора, например К+. На дисплее появится надпись:
К…… Заряд +
М.М
6. Нажимают кнопку «ВВОД», при этом вернется режим «рН-метр-иономер».
7. Нажимают кнопку «ИЗМ». На дисплее появятся результаты измерения ЭДС: ххх,х мВ.
8. Нажимают кнопку «ОТКЛ» для выхода из режима измерения.
2.1.2. Исследование условий определения методом ионометрии
Для определения компонентов технологических растворов, сточных и природных вод необходимо провести определенные исследования.
При работе с ИСЭ проводят калибровку электрода – устанавливают зависимость между потенциалом электрода и концентрацией определяемого иона. Для этого выполняют измерения потенциала в серии стандартных растворов. Стандартные растворы чаще всего готовят путем последовательного десятикратного разбавления исходного стандартного раствора дистиллированной водой. Полученные экспериментальные данные используют для построения градуировочного графика Е = f (pС), по которому устанавливают следующие электрохимические характеристики ИСЭ:
1. Нернстовская область электродной функции – интервал концентраций, в котором соблюдается прямолинейная зависимость Е = f (pС);
2. Крутизна электродной функции – угловой коэффициент наклона градуировочного графика; находят как тангенс угла наклона прямой и сравнивают с теоретическим значением. Согласно уравнению Нернста для однозарядных ионов он равен 59 мВ/ед. рС
Затем проверяют стабильность градуировочного графика во времени, проводя повторные измерения через несколько дней, и определяют время отклика электрода, т.е. время установления постоянного значения потенциала после помещения ИСЭ в раствор.
Если в растворе присутствуют ионы, которые могут мешать определению, необходимо проверить их влияние на градуировочную зависимость. Для этого приготавливают фоновый раствор, содержащий все компоненты анализируемого раствора, кроме определяемого иона. Затем готовят стандартные растворы, используя при разбавлении фоновый раствор. На этом фоне проверяют и строят градуировочную зависимость.
Природных и сточных водах
Методом прямой потенциометрии можно определять содержание в растворе многих катионов и анионов: H+, Na+, K+, Ca2+, Mg2+, Cu2+, Cl–, F–, CSN–, NO3–, S2– и других. Определение проводят методом ионометрии с использованием градуировочного графика.
Порядок выполнения работ
1. Подготовка рН-метра и электродов к работе;
2. Приготовление стандартных растворов определяемого иона;
3. Измерение потенциала в стандартных растворах;
4. Расчёт уравнения градуировочного графика, построение графика и установление электрохимических характеристик ИСЭ;
5. Измерение потенциала электрода в анализируемом растворе, набор статистических данных, для этого проводят 5-6 повторных измерений;
6. Определение концентрации определяемого иона;
7. Математическая обработка результатов.
Работа 1. Определение рН растворов
Цель работы: Определении рН различных растворов методом прямой потенциометрии с использованием градуировочного графика Е = f (pH). Оценка правильности и воспроизводимости результатов определения.
Реактивы, посуда, приборы:
Стандартный раствор кислоты НС1 0,500 М;
Стандартный раствор хлорида калия КС1 0,500 М;
Стандартный раствор янтарной кислоты С4Н6О4 0,500 М;
Стандартный раствор тетрабората натрия Na2B4O7 0,250 M;
Стандартный раствор уксусной кислоты CH3COOH 1,00 M;
Стандартный раствор ацетата натрия CH3COONa 1,00 M;
Стандартный раствор гидроксида натрия NaOH 1,00 M;
Стандартный раствор борной кислоты H3BO3 0,200 M;
Колбы мерные вместимостью 50,00 мл – 4 шт.;
Стаканчики с размешивателями на 50 мл – 5 шт.;
Иономер;
Магнитная мешалка;
Индикаторный электрод – стеклянный;
Электрод сравнения – хлоридсеребряный.
Выполнение работы
1. Определение значения рН раствора по индикаторной бумаге.
Для определения рН раствора методом градуировочного графика необходимо предварительно выяснить приблизительную величину рН раствора, чтобы знать, какие буферные растворы необходимо приготовить для точных измерений. Для этого можно воспользоваться универсальной индикаторной бумагой, которая дает переход окраски при всех значениях рН. Определяют приблизительное значение рН анализируемого раствора и записывают в лабораторный журнал.
2. Приготовление буферных растворов.
Определив приблизительное значение рН растворов, выбирают по таблице 2.1 четыре буферных раствора с такими значениями рН, чтобы два буферных раствора имели более кислую реакцию, а два – более щелочную реакцию по сравнению с анализируемым раствором.
Готовят выбранные буферные растворы в мерных колбах вместимостью 50,00 мл. Для этого пипетками наливают необходимое число миллилитров каждого компонента буферного раствора согласно таблице 2.1, доводят объем буферного раствора в колбе до метки дистиллированной водой и тщательно перемешивают.
3. Построение градуировочного графика.
В четыре сухих стаканчика помещают по одному размешивателю и наливают до половины стакана приготовленные буферные растворы. Стеклянный и хлоридсеребряный электроды погружают в буферный раствор с наименьшим значением рН на расстоянии 1 см от дна стакана. При постоянном перемешивании раствора через 1-2 мин. после установления равновесия измеряют потенциал стеклянного электрода (Е, мВ), следуя инструкции, приведенной в разделе 2.1.1. Каждый раз после измерения потенциала электроды споласкивают из промывалки дистиллированной водой и осушают полосками фильтровальной бумаги. Затем поочередно проводят измерения Е во всех приготовленных буферных растворах, переходя последовательно от низких значений рН к более высоким. Полученные результаты записывают в таблицу 2.2.
Таблица 2.2 – Результаты измерений потенциала в зависимости от рН
|
Буферные растворы
| Анализируемый раствор
|
||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 270; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.23.127.197 (0.136 с.) |
|||||||



