
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Визначення вмісту розчиненого кисню методом Вінклера
Класичним методом визначення вмісту розчиненого кисню є йодометричний метод Вінклера. Визначення цього параметру проводять одразу після відбору проби води. Йодометричне визначення розчиненого кисню ґрунтується на його взаємодії з гідроксидом мангану в лужному середовищі: При підкисленні розчину сульфатною або хлоридною кислотами (рН < 1), в присутності надлишку йодистого калію,
Йод, який виділився, титрують розчином тіосульфату калію в присутності індикатора – крохмалю (рівняння 16.3). Вміст кисню у воді можна визначити за кількістю витраченого на титрування тіосульфату натрію. Згідно із законом еквівалентів, кількість еквівалентів Для визначення кисню використовують реактиви: · розчини хлориду або сульфату мангану (II). Розчиняють 400 г · лужний розчин йодиду калію. Готують два розчина: а) 150 г · розчин сульфатної кислоти (1:4); · 0,02 н. розчин тіосульфату натрію; · 0,5% – вий розчин крохмалю. Методика визначення Для визначення кисню використовують спеціальні кисневі склянки. 1. Перед безпосереднім визначенням необхідно відкалібрувати кисневу склянку. Для цього зважити на технічних терезах з точністю до 0,01 г порожню кисневу склянку з пробкою. Потім заповнити склянку по вінця дистильованою водою, закрити пробкою таким чином, щоб не залишилося пухирців повітря, і знову зважити. Різниця між масою склянки з водою і без води дає масу дистильованої води та її об’єм.
2. У відкалібровану склянку певної місткості за допомогою лійки з гумовою трубкою, яка занурена до дна, обережно налити по вінця досліджувану воду, запобігаючи утворенню на внутрішній поверхні склянки пухирців повітря. Окремими піпетками (з подовженими носиками) додати послідовно 1 мл розчину хлориду або сульфату мангану (II) та 1 мл розчину лужного розчину йодиду калію. Це процедура фіксації розчиненого кисню. Потім швидко закрити склянку пробкою таким чином, щоб не утворилися пухирці повітря. При цьому частина води (2 мл) буде витиснена зі склянки пробкою. На дні склянки утворюється білий осад Mn(ОН)2. Вміст склянки старанно перемішати і поставити склянку для відстоювання утвореного осаду не менше ніж на 10 хвилин. За цей час під дією кисню води білий осад буріє, в результаті утворення осаду 3. Далі пробу води підкислюють, додаючи піпеткою 5 мл розчину сульфатної кислоти (1:4). Піпетку спочатку занурюють майже до поверхні осаду і (в міру витікання розчину) повільно її піднімають таким чином, щоб осад не скаламутився. Частина прозорого розчину, яка виливається зі склянки, на результат визначення не впливає. Склянку закривають пробкою і перемішують розчин. Дають постояти розчину в темному місці ще 5–7 хвилин. Бурий осад 4. Розчин з кисневої склянки переливають у чисту конічну колбу місткістю 200–250 мл і негайно титрують 0,02 н. розчином тіосульфату натрію до світло-жовтого забарвлення. Далі додають 1 мл 0,5% – вого розчину крохмалю (розчин набуває синього забарвлення) і продовжують титрувати до світло–зеленкуватого забарвлення. Вміст розчиненого кисню (
де
8 – молярна маса еквіваленту кисню, г/моль;
2 – об’єм води, який вилився при фіксації розчиненого кисню, мл.
За отриманими результатами можна розрахувати ступінь насичення води киснем. Ступінь насичення води киснем (
де
Величину Х0 ( Х0 (О 2) (мг / л) = 4,505· 10-3 ·t2 – 3,716· 10-1 · t + 14,650.
Рекомендовані джерела
1. Алексеев В.Н. Количественный анализ [Текст] / В.Н. Алексеев. - М.: Химия, 1972. – 504с. 2. Васильев В.П. Аналитическая химия. В 2 ч. [Текст] / В.П. Васильев. - М.: Высш. школа, 1989 3. Пилипенко А.Т. Аналитическая химия. В двух книгах [Текст] / А.Т. Пилипенко, И.В. Пятницкий. -М.: Химия, 1990 4. Харитонов Ю.Я. Аналитическая химия (аналитика). В 2 кн. [Текст] / Ю.Я. Харитонов.- М.: Высш. щкола., 2001 5. Гвоздяк П.І. Біологічні аномалії води або чотири запитання для обміркування [Текст] / П.І. Гвоздяк // Вісник НАН України. – 2005. – № 4. – С. 45-51. 6. Руководство по контролю качества питьевой воды [Текст]. Изд. 2-е, т.1 (рекомендации). —Женева, Всемирная организация здравоохранения, 1995. – 257c. 7. Директива Совета Европейского Союза 98/83/ЕС от 3 ноября 1998г. по качеству воды, предназначенной для потребления человеком [Текст]: от 3 ноября 1998 г, изданная 5 декабря 1998 г. в Official Journal of the European Communities. —1998. – 54с. 8. ГОСТ 2874–82. Вода питьевая. Гигиенические требования и контроль за качеством [Текст]. – 7с. 9.Державні санітарні правила і норми ДСанПіН “Вода питна. Гігієнічні вимоги до якості води централізованого господарсько-питного водопостачання” [Текст]. Затверджено наказом МОЗ України 23.12.1996 № 383 // Вода питна: Нормативні документи: Довідник. – Львів: 2001. С. 216–224. 10. Беликов С.Е. Водоподготовка. Справочник профессионалов [Текст] / С.Е. Беликов. – М.: Аква-Терм, 2007. – 241с. 11. ГОСТ 27065-86 (CT СЭВ 5184-85) Качество вод. Термины и определения. 12. Кульский Л.А. Справочник по свойствам, методам анализа и очистке води. В двух частях [Текст] / Л.А. Кульский, И.Т. Гороновский. – Киев: Наукова думка, 1980. – 680с. 13. Фрог Б.Н. Водоподготовка [Текст] / Б.Н. Фрог, А.П. Левченко. – М.: Изд. МГУ, 1996. – 680с. 14. Методы определения вредных веществ в воде водоемов [Текст] / под ред. А.П. Шицковой. – М.: Медицина, 1981. – 376с. 15. Кульский Л.А. Химия и микробиология воды. Практикум [Текст] / Л.А. Кульский, Т.М. Шевченко, М.В. Петрова – К.: Вища шк. 1987. – 175с. 16. Набиванець Б.Й. Аналітична хімія природного середовища [Текст] / Б.Й. Набиванець, В.В. Сухан, Л.В. Калабіна. – К.: Либідь, 1996. – 304с. Додаток
|
||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 147; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.223.123 (0.008 с.) |

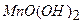 відновлюється до двовалентного мангану (
відновлюється до двовалентного мангану (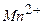 ), окислюючи при цьому йодистий калій до вільного йоду, кількість якого еквівалентна вмісту розчиненого кисню:
), окислюючи при цьому йодистий калій до вільного йоду, кількість якого еквівалентна вмісту розчиненого кисню: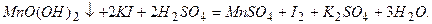
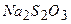 , що пішла на титрування вільного йоду, дорівнює кількості еквівалентів
, що пішла на титрування вільного йоду, дорівнює кількості еквівалентів 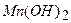 і відповідно кількості еквівалентів кисню. Визначенню заважають зависі (адсорбують йод), органічні речовини, нітрити, двох – і – трьохвалентне залізо та інші окисники та відновники. Зазначені вище перешкоди при аналізі поверхневих вод зазвичай невеликі й додаткові операції потрібні в порівняно рідких випадках.
і відповідно кількості еквівалентів кисню. Визначенню заважають зависі (адсорбують йод), органічні речовини, нітрити, двох – і – трьохвалентне залізо та інші окисники та відновники. Зазначені вище перешкоди при аналізі поверхневих вод зазвичай невеликі й додаткові операції потрібні в порівняно рідких випадках.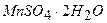 або 480 г
або 480 г 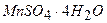 , або 425 г
, або 425 г 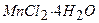 у дистильованій воді і доводять об’єм розчину до позначки. Фільтрують крізь паперовий фільтр або зливають через сифон після повного відстоювання осаду;
у дистильованій воді і доводять об’єм розчину до позначки. Фільтрують крізь паперовий фільтр або зливають через сифон після повного відстоювання осаду;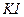 розчиняють у 100 мл дистильованої води. При підкисленні розчину він не повинен виділяти вільний йод; б) 500 г
розчиняють у 100 мл дистильованої води. При підкисленні розчину він не повинен виділяти вільний йод; б) 500 г 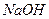 або 700 г
або 700 г 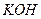 розчиняють у 800 мл прокип’яченої дистильованої води. Обидва розчини змішують і доводять об’єм до 1 л дистильованою водою;
розчиняють у 800 мл прокип’яченої дистильованої води. Обидва розчини змішують і доводять об’єм до 1 л дистильованою водою;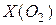 , мг/л) обчислюють за формулою
, мг/л) обчислюють за формулою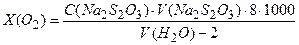 мг/л,
мг/л,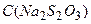 – молярна концентрація тіосульфату натрію
– молярна концентрація тіосульфату натрію 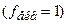 , моль/л;
, моль/л; – об’єм розчину
– об’єм розчину  , витрачений на титрування, мл;
, витрачений на титрування, мл;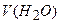 – об’єм проби води, мл;
– об’єм проби води, мл;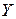 ) - це відносний вміст кисню у воді (виражений у відсотках) від його рівноважного вмісту при певній температурі, атмосферному тиску 760 мм. рт. ст. і загальній мінералізації води до 1000 мг/л. Обчислюють
) - це відносний вміст кисню у воді (виражений у відсотках) від його рівноважного вмісту при певній температурі, атмосферному тиску 760 мм. рт. ст. і загальній мінералізації води до 1000 мг/л. Обчислюють 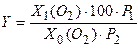 ,
,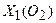 – поточна концентрація кисню у воді за певної температури, мг/л;
– поточна концентрація кисню у воді за певної температури, мг/л; –рівноважна концентраціякисню у воді (мг/л) за тієї ж температури й атмосферному тиску (
–рівноважна концентраціякисню у воді (мг/л) за тієї ж температури й атмосферному тиску (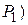 760 мм рт. ст. або 1013 гПа – знаходять за табличними даними [12, 15];
760 мм рт. ст. або 1013 гПа – знаходять за табличними даними [12, 15];  – поточний атмосферний тиск (мм рт. ст. або гПа).
– поточний атмосферний тиск (мм рт. ст. або гПа). 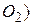 для різних температур (
для різних температур ( можна обчислити за формулою
можна обчислити за формулою


