Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нециклические инфекционные процессы
Генерализация ВИЧ. Трансмиссионный потенциал ВИЧ. Нарушения иммунной системы при ВИЧ-инфекции. Антигенные детерминанты ВИЧ. Антитела с широким нейтрализующим действием. Антигенные свойства V3-домена gp120 ВИЧ. Первичный антигенный грех (original antigenic sin, OAS). Комплемент. Феномен антителозависимого усиления инфекции (antibody-dependent enhancement, ADE; immune enhancement of disease) при ВИЧ-инфекции. Инфекционно-эволюционные качели. Эволюционный смысл ВИЧ-инфекции.
Изучение циклических инфекционных процессов, начавшееся в конце XIX столетия, сформировало определенные стереотипы мышления у эпидемиологов и инфекционистов. Основным является убеждение в том, что любой инфекционный процесс должен завершаться и оставлять хотя бы кратковременный иммунитет, т. е. невосприимчивость переболевшего организма к повторному инфицированию этим же микроорганизмом. И, на первый взгляд, вроде бы так оно и происходит в отношении ВИЧ-инфекции. Иммунная система распознает ВИЧ, циркулирующий в кровеносном русле, также легко, как и ВНО, об этом свидетельствуют клеточно-опосредованные и гуморальные иммунные ответные реакции. Однако торможения ВИЧ-инфекции не происходит. Генерализация ВИЧ. В организм человека ВИЧ попадает как эволюционно сложившимися путями для передачи ретровирусов — половым (т. е. через слизистую оболочку полового пути) и через плаценту от матери к плоду; так и артификационными (искусственными) путями, не встречающимися при естественном распространении ретровирусов — через кровь ВИЧ-инфицированых доноров и посредством инъекций ВИЧ-инфицированных наркотиков. У вируса существуют и другие возможности передачи, появляющиеся в высокоплотных популяциях ВИЧ-инфицированных людей в отдельных географических регионах, но их мы рассмотрим в главе 4. В отличие от ВНО, ВИЧ распространяется по организму человека не только фагоцитирующими клетками, но Т- и В-клетками, тромбоцитами и эритроцитами (Horakova E. et al., 2004). Другие принципиально важные отличия ВИЧ-инфекции от натуральной оспы включают участие в процессе генерализации ВИЧ клеток иммунной системы, отвечающих за Т- и В-клеточные ответы, ВИЧ-специфических антител и факторов, традиционно относимых учеными к системе врожденного иммунитета (innate immune system; см. ниже " Комплемент" и "Феномен антителозависимого усиления инфекции»). Продолжительность самого процесса генерализации ВИЧ ограничена не ответными реакциями иммунной системы (как при генерализации ВНО), а продолжительностью жизни инфицированного человека. И, наконец, иммунная система человека сама поддерживает существование способных к инфекции вирионов ВИЧ (см. подглаву 2.3 " Белки AID/APOBEC " и "TRIM5альфа"), в чем ее никак не заподозришь при натуральной оспе.
Первыми в контакт с ВИЧ вступают фагоцитирующие клетки. Они доставляют ВИЧ в лимфоидную ткань, где он инфицирует Т-хелперы (лимфоциты CD4). В воспаленных лимфоузлах повышается количество молекул межклеточной адгезии и сосудисто-клеточных адгезивных молекул, «привлекающих» в лимфатические узлы лимфоциты, циркулирующие в кровяном русле (также в основном Т-хелперы). «Взаимоотношения» ВИЧ с макрофагами более подробно будут рассмотрены в подглаве 3.3. ВИЧ может инфицировать как быстро делящиеся клетки, так и клетки, подвергшиеся конечной дифференцировке, такие как макрофаги, и не делящиеся лимфоциты CD4. Когда ВИЧ проникает в покоящуюся CD4 T-клетку, он подвергается в ее цитоплазме обратной транскрипции, но преинтеграционный комплекс (preintegration complex, PIC) быстро деградирует и клетка «излечивается» от вируса. Это происходит в том случае, если клетка не будет предварительно активирована. В основном в клетке преобладает неактивная и лабильная форма ДНК ВИЧ, и только около 1 % всех покоящихся CD4 Т-клеток инфицированного индивидуума содержат интегрировавшуюся с ее геномом ДНК ВИЧ, т. е. провирус. Для того чтобы ВИЧ начал реплицироваться, CD4 T-клетки, несущие PIC, должны быть активированы. В этом случае PIC импортируется в ядро клетки, и жизненный цикл ВИЧ возобновляется. Клетка начинает продуцировать вирусное потомство (детали этого процесса см. в работе Roth M. J. et al., 1989). Благодаря наличию белка слияния gp41 вирус инициирует слияние инфицированных и неинфицированных Т-клеток и образование обширных синтициальных структур, сходных по своему строению с синцитиотрофобластным слоем участка плаценты, где начинается взаимодействие матери и плода; и с домногоклеточными формами жизни, называемыми эдиакарской фауной (см. подглаву 2.3).
Процесс обратной транскрипции сопровождается большим количеством ошибок. Все молекулы вирусной РНК реплицируют через ассиметричную транскрипцию с одной цепи, исключающую большинство корректирующих механизмов, характерных для репликации ДНК. В результате появляется большое количество разных вариантов вируса, что учеными воспринимается в качестве некой «уловки» вируса, не желающего, чтобы против него создали вакцину. Для ВИЧ этот феномен оборачивается тем, что большинство его частиц выходят из клетки дефектными, не способными к самостоятельной репликации. Однако блокирования инфекции не происходит по следующим причинам. Дефектные вирусные геномы способны генерировать инфекционно компетентные вирусные частицы благодаря комплементации и/или рекомбинации с другими дефектными геномами, присутствующими в геноме инфицированных клеток во множестве копий провирусной ДНК. Между дефектными вирусными геномами возможны негенетические взаимодействия (nongenetic interactions), которые включают фенотипическое смешивание (phenotypic mixing), генотипическое смешивание (genotypic mixing), интерференцию (interference) и комплементацию (complementation). В саму вирусную частицу клеткой упаковываются два вирусных генома. Клетка, содержащая множество копий провирусной ДНК, может продуцировать вирусные частицы, содержащие РНК-геномы одной провирусной ДНК (гомотипичные вирионы) или РНК-геномы от разных провирусов (гетеротипичные вирионы). Эта модель предполагает генерацию рекомбинантов между ретровирусами, которые дают недефектную провирусную ДНК (Inoue M. et al., 1991). Дефектный ВИЧ, попадая в межклеточное пространство, становится идеальным антигеном для активации CD4 T-клеток. Активированные CD4 Т-клетки начинают делиться и осуществляют клональную экспансию. В таком состоянии они становятся высокочувствительными к инфицированию экзогенными ВИЧ. В них же происходит устранение вирусов, дефектных по гену белка Vif (фактор инфекционности вируса) (см. подглаву 2.3 «Белки AID/APOBEC»). ВИЧ избирательно поражает именно специфичные к ВИЧ Т-хелперы. Такие клетки у инфицированных ВИЧ индивидуумов на всех стадиях болезни содержат больше ДНК ВИЧ, чем CD4+ T-клетки с другой специфичностью (Douek D. C. et al., 2002). Стерильного иммунитета, как при инфекции, вызванной ВНО, при ВИЧ-инфекции не наступает. Во-первых, ВИЧ поддерживается и реплицируется в фагоцитирующих клетках (Trujillo R. et al., 2007). Во-вторых, отдельные активированные инфицированные Т-клетки «переживают» инфекцию и становятся длительно живущими латентными носителями вируса. Их реактивация дефектными частицами ВИЧ и другими факторами вновь приводит к активной репликации вируса (Finzi D. еt al., 2006). Высокая скорость мутаций при обратной транскрипции и высокая скорость репликации ВИЧ дают не только большое количество дефектных вирусов, но и генерируют большое количество их вариантов. Особенно этот процесс дает о себе знать после сероконверсии и перехода болезни в асимптоматическую стадию, и, что крайне важно еще осмыслить, он не носит случайный характер, так как в его осуществлении принимает активное участие Т- и В-клеточная составляющая иммунной системы человека.
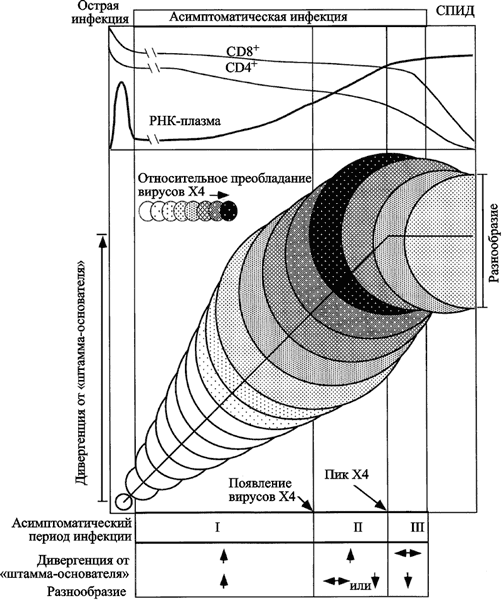
R. Hankarra et al. (1999) у ВИЧ-инфицированных пациентов, так называемых умеренных прогрессоров (moderate progressors), в пределах асимптоматической стадии ВИЧ-инфекции выделяют три фазы дивергенции и три фазы роста разнообразия ВИЧ. Под дивергенцией (divergence) эти авторы понимают различия между нуклеотидной последовательностью исходного вируса и последовательностью вируса, полученного от ВИЧ-инфицированного человека через какое-то время после инфицирования. Под разнообразием (diversity) — различия в нуклеотидных последовательностях ВИЧ в данной временной точке. На ранней фазе инфекции развиваются оба процесса; промежуточная фаза характеризуется непрерывным увеличением дивергенции ВИЧ, но стабилизацией или даже снижением его разнообразия; поздняя фаза проявляется снижением темпа или даже стабилизацией процессов дивергенции и формирования разнообразия вируса (рис. 47).
Рис. 47. Схематическое изображение развития ВИЧ-инфекции у умеренных прогрессоров по R. Shankarappa et al., 1999(a)
Клинические стадии ВИЧ-инфекции, динамика CD4+ и CD8+ T-клеток и нагрузки вирусной РНК в плазме. (b) Эволюция вирусных последовательностей в пределах асимптоматического периода ВИЧ-инфекции. Диаметры кругов приблизительно соответствуют разнообразию (diversity) вирусной популяции от сероконверсии (первый круг). Вертикальное смещение кругов показывает степень дивергенции вирусной популяции (divergence) от предкового штамма (founder strain). Затенения соответствуют пропорции вирусной популяции, представленной X4-генотипом. Вертикальные линии (начиная с левой стороны схемы) соответствуют: окончанию стадии острой инфекции; пику вирусного разнообразия; стабилизации дивергенции от предкового штамма; развитию СПИДа.(c) Характерные изменения вирусной эволюции во время асимптоматического периода ВИЧ-инфекции, разделенные на три фазы (см. в тексте). К росту генетического разнообразия ВИЧ причастна иммунная система человека. По данным Zhang H. et al. (2005) увеличение генетического разнообразия вируса субтипа С у детей зависит от антител с широким нейтрализующим действием. Чем выше титр таких антител, тем больше на данный момент времени вирусы различаются между собой (об антителах с широким нейтрализующим действием при ВИЧ-инфекции см. ниже). Макрофаготропные варианты ВИЧ (M-tropic или R5) предпочтительно нацеливаются на CC-хемокиновый корецептор 5 (CCR5) — экспрессирующих клеток. Т-тропные варианты ВИЧ (T-tropic или X4) используют для проникновения в клетку CXC-хемокиновый корецептор 4 (CXCR4). Бывают варианты вируса с двойной тропностью (dual-tropic isolates). Вне контекста представлений о роли ретровирусов в эволюции клеточных форм жизни (см. подглаву 1.1) процесс накопления разных вариантов ВИЧ выглядит случайным, как проявление некой способности ВИЧ «постоянно меняться».
Присмотримся к X4-вариантам ВИЧ, появляющимся вполне закономерно в период ранней и в начале промежуточной фазы дивергенции (роста разнообразия) ВИЧ (см. рис. 47). CXCR4-корецептор (см. табл. 9) представлен на миелоидных клетках, Т- и В-клетках, макрофагах, эпителиальных, эндотелиальных и дендритных клетках (Bleul C. et al., 1997; Chensue S. W., 2001; Белоцкий С. М., Авталион З. З., 2006). Наиболее опасны такие варианты вируса для Т-клеток. Элиминация Т-тропными ВИЧ Т-клеток-хелперов облегчает существование ВИЧ-инфицированных макрофагов, и, соответственно, самого ВИЧ, так как Т-клетки-хелперы выступают в роли организаторов многосторонних процессов, направленных на уничтожение инфицированных макрофагов. В этом положении нет противоречий с тем фактом, что в Т-клетках происходит устранение ВИЧ, дефектных по гену белка Vif (см. подглаву 2.3. «Белки AID/APOBEC»). Во-первых, процесс растянут во времени (см. рис. 47); во-вторых, макрофаги сами имеют систему, аналогичную APOBEC Т-лимфоцитов. Следовательно, мы вновь сталкиваемся с событиями, начавшимися еще в Архее — с поддержанием ретровирусов одноклеточными формами жизни (см. ниже «Эволюционный смысл ВИЧ-инфекции»). В масштабе времени, воспринимаемом нами, он проявляется снижением эффективности высокоактивной антиретровирусной терапии (highly active antiretroviral therapy, HAART). Появление CXCR4-вариантов ВИЧ у некоторых пациентов может быть ускорено нерациональной антиретровирусной терапией. Например, после монотерапии 64 ВИЧ-инфицированных пациентов в течение 10 суток антагонистом корецептора CCR5, маравиром (maraviroc, MVC, UK-427857), у двух из них к концу курса лечения были обнаружены CXCR4-варианты ВИЧ на фоне снижения вирусной нагрузки. Авторы работы считают, что эти варианты ВИЧ уже присутствовали у пациентов в незначительных количествах, селективное давление маравира на CCR5-тропные клоны вируса создало им преимущества (Westby M. et al., 2006). В начале поздней фазы дивергенции (роста разнообразия) количество X4-вариантов ВИЧ начинает снижаться. Эта фаза проявляется нарушением гомеостаза Т-клеток. Количество CD4+ T-клеток снижается до уровня <200 клеток/мм3, появляются симптомы выраженного поражения клеточной системы иммунитета, болезнь переходит в стадию СПИДа. Теперь разнообразие вариантов вируса идет на убыль, так как иммунная система истощена и уже не способна раскручивать маховик его эволюции. Трансмиссионный потенциал ВИЧ. Трансмиссионный потенциал ВИЧ трудно сопоставить с трансмиссионным потенциалом ВНО в конкретных цифрах лиц, инфицированных от одного ВИЧ-положительного пациента, как это сделано в предыдущей подглаве для ВНО. Инфекционный и эпидемический процессы при ВИЧ-инфекции носят нециклический характер и фактически необратимы (эпидемический процесс для микроорганизмов, использующих стратегию паразитизма второго типа — см. подглаву 4.2). К тому же они происходят в других, несравнимо больших временных и территориальных масштабах. Поэтому эпидемические цепочки, по которым распространяется ВИЧ, ограничены лишь количеством людей, живущих на данной территории.
Вирусная нагрузка при ВИЧ-инфекции характеризуется растянутой U-образной кривой (см. рис. 47). Наибольшая она в начале инфекции, когда ВИЧ размножается только за счет ресурсов реликтовой иммунной системы и вне контроля со стороны Т- и В-составляющей иммунной системы человека. В этот короткий период вирусная нагрузка мало различается у ВИЧ-инфицированных пациентов, их трансмиссионный потенциал (т. е. способность передавать вирус половым партнерам) максимален (Fraser C. et al., 2007). В отсутствие антиретровирусной терапии, через несколько месяцев, виремия достигает постоянного уровня (стадия асимптоматической инфекции) — который сильно различается от больного к больному (Ледерман М. С. соавт., 2004). Но с появлением X4-вариантов ВИЧ количество вирусных частиц в крови начинает медленно расти. Вирус появляется во все новых и новых клетках и тканях (макрофаги, почки, костный мозг и др.), трансмиссионный потенциал ВИЧ-инфицированного пациента вновь растет. Весьма любопытен результат контроля над ВИЧ со стороны Т- и В-составляющей иммунной системы человека. На первый взгляд кажется, что иммунная система просто не выдерживает неравной борьбы с вирусом. И хотя ясно, что пациенты с большей вирусной нагрузкой более инфекционны, чем пациенты с низкой, и прогноз течения их болезни хуже, тем не менее не они обладают наибольшим трансмиссионным потенциалом. По данным C. Fraser et al. (2007), вирусная нагрузка, проявляющаяся максимальным трансмиссионным потенциалом, соответствует 4.52 log10 копий вируса на мл крови, что составляет среднюю величину от максимально возможной. Индивидуумы с высокой вирусной нагрузкой в действительности бывают способными к эффективной передаче вируса лишь короткое время, с низкой — не обладают такой способностью. И только у лиц с промежуточной вирусной нагрузкой вклад в поддержание эпидемических цепочек наиболее значителен, так это связано с длительным периодом асимптоматического течения инфекции. Получается, что контроль со стороны Т- и В-составляющей иммунной системы человека направлен на максимальное распространение ВИЧ среди людей. Нарушения иммунной системы при ВИЧ-инфекции. Кратко они обобщены в табл. 13.
Таблица 13. Нарушения иммунной системы при ВИЧ-инфекции [18]
Иммунная система | Нарушения Реликтовая иммунная система Антигенпредставляющие клетки (моноциты и дендритные клетки) | Сниженная стимуляция пролиферации Т-лимфоцитов после презентации антигена — "- | Снижение экспрессии молекул HLA-DR — "- | Нарушение синтеза цитокинов Фагоциты | Снижение разрушения старых эритроцитов в селезенке — "- | Снижение экспрессии Fc-рецепторов — "- | Снижение способности к хемотаксису — "- | Снижение способности к уничтожению фагоцитированных возбудителей | — "- Снижение продукции кислородных радикалов Нейтрофилы | Нейтропения — "- | Сниженная или повышенная способность к хемотаксису — "- | Снижение антистафилококковой активности — "- | Снижение или повышение фагоцитоза — "- | Изменение соотношения рецепторов и молекул адгезии на клеточной мембране
|
|||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 65; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.63.87 (0.027 с.) |