Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Циклические инфекционные (моно)процессы
Генерализация поксвирусной инфекции. Антигенная детерминанта ВНО. Иммунные ответы на ВНО. Трансмиссионный потенциал ВНО. Продолжительность противооспенного иммунитета.
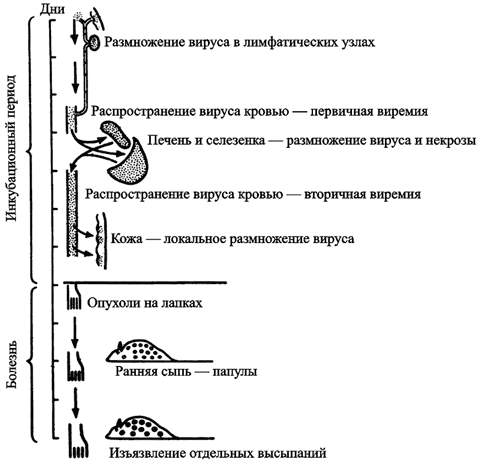
ВНО легко обнаруживается иммунной системой человека. Он индуцирует полный спектр клеточно-опосредованных и гуморальных иммунных ответных реакций. Заболевший начинает активно выделять вирус в первую неделю от начала болезни, когда происходит вскрытие оспенных элементов на слизистой ротовой полости, зева и глотки. Количество же антител, нейтрализующих инфекционность вируса, достигает своего максимума между 12 и 15 днями болезни. Но уже на 10-е сутки болезни заразность больного для окружающих резко снижается. Через 4 недели от начала болезни вирус уже невозможно выделить из отделяемого носоглотки и из мочи реконвалесцента. Выздоровление у заболевших людей полное (Маренникова С. С., Щелкунов С. Н., 1998). Таким образом, во взаимоотношениях ВНО с организмом человека просматривается определенная стратегия паразитизма. Попробуем понять, из чего она складывается. Генерализация поксвирусной инфекции. С 1940-х гг. наиболее адекватной моделью инфекционного процесса, вызываемого ВНО у человека, считается эктромелия мышей (Mark R. L. et al., 1991; Fenner F., 1948). Возбудитель болезни (Ectromelia virus, EV) относится к семейству Orthopoxvirus. Ортопоксвирусы консервативны. Они имеют более чем 90 % гомологии в центральном 100-Кд регионе генома (Esteban D. J., Buller R. M., 2005). Сходство патогенезов болезней, вызываемых ВНО и EV, включает быстрое размножение вируса при его низкой инфицирующей дозе, сходство цитокиновых ответов на вирус и сходные кожные поражения на последней стадии болезни, включающие орофарингеальную секрецию вируса, критическую для его трансмиссии (Chaudhri G. et al., 2006). Генерализация вируса эктромелии изучена в деталях (рис. 43).
Рис. 43. Генерализация ортопоксивурусов на примере вируса эктромелии у мышей (по Fenner F., 1948)
Процесс генерализации возбудителя болезни осуществляется благодаря макрофагам. Вирус ведет себя как их паразит и быстро размножается. В отличие от ВИЧ (см. раздел 3.2) он не поддерживается в макрофагах в качестве эндосимбионта, а активно их разрушает, затем попадает в кровь, где может «встретиться» со специфическими антителами.
Первыми клетками, вступающими в контакт с поксвирусами, являются полиморфоядерные лейкоциты (макрофаги и моноциты). За счет градиента продуцируемых ими хемоаттрактантов они «притягивают» другие фагоцитирующие клетки и запускают каскад самых разнообразных реакций, которые «в сумме» рассматриваются учеными как «иммунные». В составе макрофагов и моноцитов вирус достигает дренажных лимфатических узлов примерно через 8 час. Разрушившиеся фагоцитирующие клетки становятся источником вируса, а через 2–3 суток его обнаруживают уже в крови (первичная виремия), костном мозге, печени и селезенке. В пробах крови больного натуральной оспой в этот период можно обнаружить как инфицированные, так и неинфицированные лейкоциты, но в основном репликация ВНО происходит в моноцитах/макрофагах, тогда как Т-лимфоциты остаются неинфицированными, но при этом наблюдается выраженная лимфопения. Вирус распространяется из лимфатических узлов фагоцитирущими клетками крови по внутренним органам через выносящие (эфферентные) лимфатические сосуды. Процесс напоминает показанный на рис. 28 для возбудителя сибирской язвы, но, естественно, без участия бактериальных факторов вирулентности. Затем вирус проникает в эпителий кожи и слизистых, где начинается его репликация. Появляются энантемы и экзантемы, инфицирование которых вторичной микрофлорой определяет эволюцию кожных элементов из везикул в пустулы. Количество вируса через 4–5 суток уже превышает емкость ретикуло-эндотелиальной системы, и он вновь проникает в кровяное русло. Вторичная виремия обычно соответствует началу клинической манифестации болезни. При всех формах эктромелии у мышей и натуральной оспы у людей, развиваются паренхиматозные изменения во внутренних органах. Циркулирующие в крови специфические антитела выявляются уже на седьмые сутки после инфицирования человека ВНО, и их максимальный уровень достигается на 14 сутки. Одновременно с нарастанием количества специфических антител, происходит снижение количества вируса в тканях (более подробно об этих процессах см. в работах Esteban D. J., Buller R. M., 2005; McFadden G., 2004; Маренниковой С. С., Щелкунова С. Н., 1998; Mark R. L. et al., 1991).
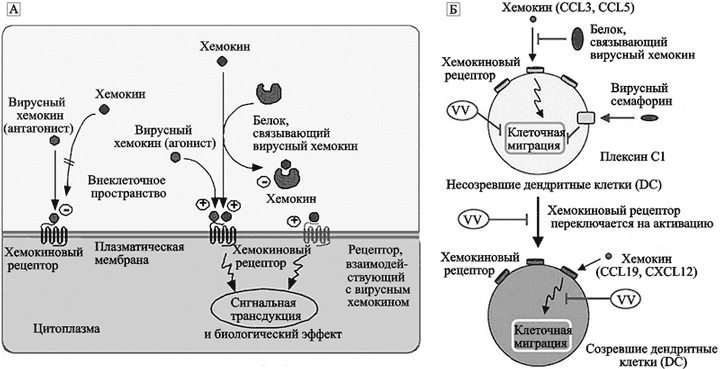
Считается, что в основе патогенеза поксвирусных инфекций лежит способность вирусов к интерференции с защитными иммунными механизмами макроорганизма (Stanford M. et al., 2007). По крайней мере, это так выглядит, если смотреть на процессы взаимодействия осповирусов со своими многоклеточными хозяевами с точки зрения, предполагающей их совместную эволюцию. Особое значение учеными придается антихемокиновой стратегии ортопоксвирусов, заключающейся в блокировании вирусными белками хемокиновой активности клеток иммунной системы хозяина. Но судя по древности хемокиновых белков, система взаимоотношений посредством сигнальных молекул между прокариотами (в том числе, вирусами) и эукариотами сложилась еще в архее, т. е. до образования многоклеточной жизни. Поэтому такая стратегия не оригинальна для ортопоксвирусов; применительно к фагоцитирующим клеткам она используется большинством ДНК-вирусов. Стратегия включает синтез инфицированными фагоцитирующими клетками вирусных гомологов хемокинов или хемокиновых рецепторов и других белков, связывающих хемокины, синтезируемые неинфицированными фагоцитирующими клетками (рис. 44; табл. 12).
Рис. 44. Модуляция хемокиновой системы вирусами
А — экспрессия вирусных гомологов хемокинов, рецепторов хемокинов и хемокинсвязывающих белков; B — частный случай антихемокиновой стратегии — ингибирование миграции созревающих дендритных клеток (DC). Вирусные хемокинсвязывающие белки интерферируют с хемокинами CCL3 и CCL5. Несозревшие DC экспрессируют воспалительные хемокиновые рецепторы (CCR1, CXCR1) и мигрируют в инфицированные ткани в ответ на такие хемокины, как CCL3 и CCL5. Созревшие DC экспрессируют CCR7 и CXCR4 и мигрируют во вторичные лимфоидные органы в ответ на CCL19 и CXCL12, где они представляют антиген «наивным» T-клеткам. Цифровые обозначения: 1 — вирусный хемокин (антагонист); 2 — вирусный хемокин (агонист); 3 —хемокиновый рецептор; 4 — рецептор вирусного хемокина; 5 — сигнальная трансдукция и биологический эффект; 6 — клеточная миграция (Alcami A., 2007).
Таблица 12. Портрет серийного убийцы: иммуномодулирующие гены ВНО [16]
Иммуномодулирующее действие | Variola major[17] | Variola minor | Комментарии IFN-альфа/бета ингибитор | B20R | D9R | Не проверено IFN-гамма ингибитор | B9R | H9R | Ингибирование человеческого IFN-гамма eIF2альфа мимикрия | C3L | D3L | Не проверено dsRNA-BP | E3L | C3L | Не проверено Ингибитор фактора некроза опухолей | G2R | G2R | Не проверено Ингибитор NF- к B | P1L | P1L | Не проверено TLR сигнальный ингибитор | A52R | A56R | Не проверено IL-18-связывающий белок | D5L | B6L | Ингибитор человеческого IL-18 Хемокин-связывающие белки | G3R | A46L | G3R ингибирует у людей хемокины CC Фактор роста вирусов | G3R | B3R | Связывает и активирует человеческий EGF-R (erbB1) Ингибитор комплемента /SPICE | D12L | B18L | Ингибирует каскад комплемента у людей GM — CSF/IL-2 ингибитор | A46R | A49L | Не проверено Семафорин | A42R | A45R | Не проверено Серпины | B13R, B25R, C2L | D14R, D2R | Не проверено
Поскольку функции хемокиновых рецепторов, посредством которых вирус взаимодействует с клеткой, различаются, то воздействие на них вирусными белками на уровне макроорганизма приводит к разным, и даже, противоположным эффектам. Это и истощение локальной хемокиновой активности; и индукция межклеточных сигналов, усиливающих вирусную репликацию; и стимуляция миграции инфицированных клеток, либо, наоборот, нейтрализация их способности к миграции. Но рассмотрение тонкостей антихемокиновых стратегий вирусов не входит в задачу данной работы (подробно с антихемокиновыми стратегиями ортопоксвирусов в организме млекопитающих можно ознакомиться по публикациям Stanford M. et al., 2007; Alcami A., 2007; Smith S. A., Kotwal G.J., 2002; Маренниковой С. С. и Щелкунова С. Н., 1998). Тем более что с ними нет полной ясности, свидетельствующей о том, что антихемокиновая стратегия ВНО в организме человека сформировалась в результате их коэволюции. Так G. McFadden (2004) обратил внимание исследователей на то, что маловирулентный ортопоксвирус, возбудитель оспоподобной болезни — аластрима (alastrim), мало уступает собственно ВНО по числу генов белков, ингибиторов иммунных ответных реакций макроорганизма (см. табл. 12). Поэтому он усомнился в правильности общепринятого понимания механизмов, благодаря которым ВНО вызывает смертельную болезнь.
В связи с его "сомнениями" выскажу и свое. ВНО имеет большое количество «выключенных» генов вирулентности. Особенно это бросается в глаза при сравнении его генома с геномами маловирулентных ортопоксвирусов, поражающих грызунов (см. в работе Маренниковой С. С., Щелкунова С. Н., 1998). Пока можно констатировать то, что только способность к паразитическому размножению в макрофагах имеет однозначное значение для оценки патогенности ортопоксвирусов. Например, LD50 вируса эктромелии с инактивированным геном р28, ответственным за его репликацию в фагоцитирующих клетках, увеличивается, по крайней мере, в 106 раз, а вирусная нагрузка в печени и селезенке дефектного штамма вируса в 1000 раз меньше, чем у исходного (Senkevich T. G. еt al, 1994). Недавно у белка, синтезируемого ВНО и способного связывать рецептор фактора некроза опухолей, обнаружили домен, инициирующий рекрутинг макрофагов к поверхности слизистых и кожи, в месте внедрения вируса (Alejo A. et al., 2006). Инфицирование ВИЧ всегда кончается смертью больного, количество же смертельных исходов при натуральной оспе сильно варьирует во время разных эпидемий и в различных группах населения. Поэтому интерес представляют реакции макроорганизма на заведомо смертельные дозы ВНО. Патогенез натуральной оспы при инфицировании такими дозами вируса изучали Jahrling P.B. et al. (2004) на обезьянах. Общей реакцией макроорганизма на проникновение вируса является рост количества фагоцитирующих клеток — моноцитов, чем позже наступает пик лейкоцитоза, тем дольше живет инфицированное животное. ВНО высевается из моноцитов и смывов из носоглотки уже на вторые сутки после инфицирования, хотя еще его не удается выделить из плазмы.
Через 2–3 суток у инфицированных приматов уже можно наблюдать отчетливо выраженные кожные поражения (везикулы и пустулы). Количество кожных поражений зависит от инфицирующей дозы. Вирусная репликация в макрофагах сопровождается явлением, которое из-за его неблагоприятного исхода, назвали «цитокиновым штормом» («cytokine storm»). Оно проявляется каскадной активацией и выбросом инфицированными макрофагами значительных количеств различных лимфокинов (monocyte chemoattractant protein 1, macrophage inflammatory protein 1бета, IFN-гамма, IL-6 и др.) и развитием клиники токсемии и шока, приводящих больного к смерти (рис. 45).
Рис. 45. Динамика патогенетических реакций обезьян на заведомо смертельные дозы ВНО штаммов Harper и India
А. общее количество белых клеток крови; Б. общее количество тромбоцитов; В. инфекционные титры вируса в смывах из гортани; Г. кожные поражения как функция дозы вируса (штамм India): 3 — 500 поражений; 2 — 50–500; 1–5–50 поражений; Д. концентрация IL-8 в пикограммах на мл (пкг/мл); Е. концентрация monocyte chemoattractant protein в пкг/мл; Ж. концентрация воспалительного белка макрофагов (macrophage inflammatory protein) в пкг/мл; З. среднее количество IFN-гамма в пкг/мл в сыворотке обезьян, инфицированных штаммами India 7124 и Harper (109 pfu). По Jahrling P.B. et al. (2004).
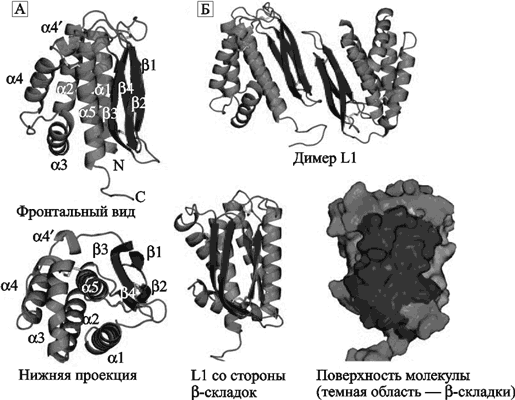
Через 2–3 суток после инфицирования ВНО у животных развивалась коагулопатия, проявившаяся геморрагическими высыпаниями в грудной и брюшной полостях и в передней камере глаза. Электронная микроскопия демонстрировала репликацию вируса в большинстве тканей внутренних органов обезьян и, особенно, в лимфатических узлах и селезенке. Фибриновые отложения и тромбы ассоциировались с выраженным размножением вируса в макрофагах. Т-лимфоцитозависимые области лимфоидной ткани обычно выглядели истощенными, тогда как макрофаги, моноциты, клетки эндотелия активно продуцировали вирус. Гибель Т-лимфоцитов происходила в результате неспецифического апоптоза (bystander apoptotic), инициированного инфицированными макрофагами. У единственного выжившего животного развился стерильный иммунитет. Антигенная детерминанта поксвирусов. Основной антигенной детерминантой поксвирусов и мишенью для протективных антител является консервативный белок L1 (другое название L1R). У вируса вакцины, вируса оспы обезьян и ВНО этот белок различается отдельными аминокислотами. Антитела к L1 способны блокировать инвазию ортопоквирусов в клетки. Поэтому он рассматривается учеными в качестве кандидата на включение в перспективные противооспенные вакцины (рис. 46).
Рис. 46. Структура белка L1.
А. Две проекции белка на ленточной диаграмме. Фронтальный вид (верхнее изображение) показывает расположение спиралей на одной стороне молекулы, на другой стороне изображены параллельные бета-складки, сформированные непараллельными бетацепями, соединенными через петлю и тремя дисульфидными связями. Нижняя проекция показывает бета3, бета4 и альфа5, упакованные вблизи центра молекулы. Обозначены спирали (альфа1-альфа5), N-конец (N), и С-конец (С). Б. Вверху показан димер L1. Взаимодействие двух L1 молекул происходит через края бета-складок. Нижнее изображение показывает L1 со стороны бета-складок (темная область). L1 — это крупная консервативная белковая молекула-мономер с несколькими конформационными эпитопами, презентируется иммунным клеткам в виде димера (Su Hua-Poo, 2005).
По данным H. Su et al. (2005), L1 играет основную роль в «созревании» вирионов ортопоксвирусов. На заключительной стадии морфогенеза вируса образуются так называемые внутриклеточные созревающие вирионы (intracellular mature virions, IMVs), которые имеют липидные мембраны и представляют собой уже способные к инфекции формы вируса. Большинство IMV высвобождаются из фагоцитирующей клетки после ее лизиса. Некоторые из них могут транспортироваться через клеточную мембрану хозяина до лизиса клетки. После чего они остаются присоединенными к ее наружной поверхности или отделяются от нее уже как внеклеточный оболочечный вирус (extracellular enveloped virus, EEV). Главную роль в передаче вируса от одного хозяина к другому играет его IMV-форма. L1 представляет собой миристиолированный оболочечный белок (myristoylated envelope protein), состоящий из 250 аминокислотных остатков. Он экспрессируется на поверхности IMV-формы вируса. Его C-гидрофобный сегмент погружен в вирусную мембрану, но консервативная часть L1, включающая 185 аминокислотных остатков, локализуется в цитоплазме клетки-хозяина. В области N-конца белка формируется гидрофобная «каверна», необходимая для сборки вириона. После лизиса клетки этот эктодомен экспонируется Т- и В-клеткам иммунной системы, и вызывает сильный ответ с их стороны. Следовательно, ключевая роль белка L1 в морфогенезе вируса предопределяет его консервативность как антигена. Поэтому другого варианта поддержания в популяциях позвоночных организмов, кроме зависящей от многих случайностей эстафетной смены хозяина, у ортопоксвирусов нет. Иммунные ответы. ВНО и другие ортопоксвирусы представляют собой очень благодарный для иммунолога объект исследования, так как иммунные реакции на них у позвоночных организмов всегда укладываются в представления об иммунитете и инфекции, сложившиеся еще в начале ХХ столетия. В таких исследованиях иммунологу открывается обширное поле деятельности по детализации прописных истин из старых учебников, поэтому я не буду повторяться. Отмечу лишь некоторые уточнения, появившиеся в последние годы на волне успехов трансгенной инженерии и имеющие отношение к цели данной работы. По данным R. Xu et al. (2004), для освобождения организма от вируса вакцины необходимо участие в иммунных ответах CD4+ T-клеток (субпопуляция Т-клеток, оказывающая помощь В-клеткам в продукции специфических антител) и MHC класса II (локализованы на поверхности макрофагов и обеспечивают включение в иммунный ответ CD4 T-клеток). Мыши, дефектные по В-клеткам (синтезируют и секретируют специфические антитела), так же как и мыши, истощенные по CD4, неспособны освободиться от вируса и погибают. Они оказались неспособны переключаться на IgG (высокоаффинный и количественно доминирующий иммуноглобулин) — или IgM (низкоаффинный иммуноглобулин, преобладающий во внутрисосудистом пуле иммуноглобулинов в начале инфекционного процесса) — ответы. В ответах на острую инфекцию, вирусоспецифические антитела наиболее эффективно освобождают организм от вируса. Вирус разрушается по различным механизмам, предполагающим участие специфических антител. Во-первых, антитела могут непосредственно связывать вирус, вызывая его агрегацию и препятствуя адсорбции и интернализации в клетках. Во-вторых, они могут связывать вирус, вызывая его разрушение с помощью комплемента или опсонизации, а затем посредством фагоцитоза. Антитела могут связывать инфицированные клетки хозяина, вызывая цитотоксические реакции со стороны клеток-киллеров и др. Истощение Т-клеток CD8 (цитотоксические клетки, способные убивать другие клетки, к антигенам которых они примированы) посредством моноклональных антител или генного нокаута, сказывалось незначительно на развитии инфекционного процесса. В антивирусной функции CD8 T-клеток много неясного. Spriggs et al. (1992) показали, что трансгенные мыши, утратившие CD8 T-клетки, способны также как и мыши в контроле, пережить инфицирование большими дозами вируса эктромелии. Но у таких трансгенных мышей синтезировалось меньше вирусоспецифических IgG, что предполагает участие активированных CD8 T-клеток в освобождении организма от вируса. R. Xu et al. (2004) показали способность мышей, дефектных по MHC класса II(_/_), и инфицированных сублетальными дозами вируса вакцины, выживать и полностью освобождаться от вируса при наличии активных CD8+ T-клеток. Их данные показывают участие CD8+ T-клеток в снижении смертности экспериментальных животных, инфицированных вирусом вакцины, однако детали этого процесса пока не ясны. Мыши с таким генетическим дефектом имели значительно меньшее по сравнению с нормой количество CD8+ T-клеток, и во время инфекции у них развивались обширные некротические повреждения в кортексе надпочечников, характерные для инфекционного процесса, вызванного вирусом вакцины. По данным G. Chaudhri et al. (2006), именно B-клетки играют ключевую роль в освобождении организма мыши от вируса эктромелии. При дефиците В-клеток и при наличии CD8 T-клеточных ответов животные неизбежно погибают от прогрессирующей инфекции. Любопытно то, что в их опытах введение животным, дефицитным по В-клеткам, «наивных» B-клеток или специфической к вирусу эктромелии сыворотки, позволяло добиться стерильного иммунитета. Информацию о важной роли гуморального звена иммунитета в противодействии ВНО можно найти и в старых работах. По данным A. Downie et al. (1958), геморрагическая форма натуральной оспы с летальным исходом развивалась при отсутствии у заболевшего нейтрализующих антител после предшествующей вакцинации. У таких больных развивалась выраженная виремия, вирус в высоких титрах обнаруживали в фарингеальном тракте. Полученные на трансгенных животных данные свидетельствуют в пользу того, что ортопоксвирусные инфекции не контролируются реликтовой системой иммунитета. Уничтожение таких вирусов осуществляется сложившейся уже в позвоночных организмах системой гуморального и клеточного иммунитета с преимущественной ролью В-лимфоцитов. Благодаря хорошей «заметности» и ранней презентации Т- и В-клеткам антигенов ортопоксвирусов, одновременно являющихся критическими для их морфогенеза, специфические антитела обладают выраженным протективным действием. Трансмиссионный потенциал ВНО. Способность ВНО передаваться от человека к человеку в иммунокомпетентных популяциях, весьма ограничена. По данным V. Bhatnagar et al. (2006), обобщивших статистическую информацию по 51 вспышке «завозной» натуральной оспы, зарегистрированной в Европе и Северной Америке в период после 1945 г., в среднем каждая такая вспышка ограничивалась четырьмя случаями болезни с одним летальным исходом. Количество передач (генераций) ВНО от заболевшего человека к здоровому, редко превышало 3; а 30 % заносных вспышек вообще не сопровождалась передачами ВНО от человека к человеку. Такую неспособность оспы к быстрому распространению в популяциях людей нельзя объяснить только предварительными массовыми вакцинациями. Например, вспышка натуральной оспы среди невакцинированного населения Abakaliki (Нигерия) в 1967 г. ограничилась всего 31 случаем болезни (Eichner M., Dietz K., 2003). В свете этих данных невозможно понять, каким образом жестокая пандемия натуральной оспы 1870–1874 гг. вспыхнула практически одновременно на нескольких континентах, если не предполагать наличие первичного природного резервуара для ВНО среди простейших. В Европе натуральная оспа во время пандемии 1870–1874 гг. не «обращала внимания» даже на двукратную противооспенную вакцинацию населения отдельных городов (детали распространения натуральной оспы в ту пандемию см. в книге Бразоля Л. Е., 1875). Продолжительность противооспенного иммунитета. Вакцинация обычно предупреждает заражение ВНО в течение, по меньшей мере, 10 лет. При развитии болезни ее симптомы у вакцинированных лиц менее выражены, чем у невакцинированных. Так как специфические антитела считаются первой линией обороны против вторжения возбудителей инфекционных болезней, их обычно выявляют для оценки иммунной защиты индивидуума. По данным Gallwitz S. et al. (2003), использовавших ферментативный иммуноанализ для поиска антител к вирусу вакцины у лиц, вакцинированных 30–60 лет назад, их можно обнаружить у 65 % обследуемых, вакцинированных однократно; и у 80 % обследуемых, вакцинированных два раза и более. Crotty S. et al. (2003) продемонстрировали присутствие у лиц, вакцинированных более 50 лет назад, специфических к вирусу вакцины В-клеток памяти. Количество таких клеток после вакцинации снижается в течение нескольких лет до уровня, представляющего примерно десятую часть от достигнутого максимума. Далее количество противооспенных антител (0,1 % от общего количества IgG+ B-клеток) не меняется практически на протяжении всей оставшейся жизни вакцинированного. Этим объясняется выраженная антительная реакция на противооспенную ревакцинацию. В опытах Frey S. E. et al. (2003) вакцинация ранее вакцинированных лиц давала очень хороший результат даже при десятикратном разведении вакцины.
%%%
В эволюционном аспекте проблемы инфекционных болезней инфекционный процесс в многоклеточных организмах представляет собой попытку микроорганизмов установить с фагоцитирующими клетками взаимоотношения, существовавшие между ними до формирования многоклеточной жизни. Такие взаимоотношения могут развиваться сразу как паразитические (оротопоксвирусы, возбудители чумы или сибирской язвы) либо начинаться с симбиоза (возбудители бруцеллеза, туберкулеза, проказы). В медицинском аспекте проблемы инфекционный процесс — это процесс диссеминации фагоцитирующими клетками микроорганизмов по органам и тканям, сопровождающийся выбросом молекул межклеточного общения (хемокинов и лимфокинов) в количествах, значительно превышающих физиологическую норму, и, соответственно, проявляющийся развитием патологических реакций (т. е. болезни). Его продолжительность лимитируется Т- и В-клеточной составляющей иммунной системой хозяина, сформировавшейся уже в процессе эволюции позвоночных организмов. При рассмотрении инфекционного процесса данного типа речь идет не о конкретном количестве суток, в течение которых начинается и прекращается инфекционный процесс, а о способности клеточной и гуморальной иммунной системы его контролировать. Например, при туберкулезе средний инкубационный период составляет 5–10 недель. У иммунокомпетентного человека клеточный иммунный ответ на гематогенную диссеминацию возбудителя болезни возникает через 2–10 недель, что останавливает его размножение. У переболевших туберкулезом людей остается относительная невосприимчивость к повторному заражению туберкулезной палочкой. Для инфекционной болезни, развивающейся вследствие инфекционного процесса, лимитируемого клеточной и гуморальной иммунной системой, характерны следующие периоды: инкубационный, продромальный, нарастания симптомов, разгара болезни, угасания клинических проявлений болезни, выздоровления (реконвалесценции) с формированием стерильного иммунитета. Поэтому такие инфекционные процессы я предлагаю назвать циклическими инфекционными процессами. Обычно они представляют собой монопроцессы, т. е. вызываются одним микроорганизмом. На примере инфекционных процессов, вызванных ВНО и другими отопоксвирусами, мы видим, что до достижения гуморальной и клеточной иммунной системой определенного максимума реакции, строгий антропоноз (зооноз) должен сменить своего хозяина, чтобы сохраниться как биологический вид. В нашем восприятии времени ВНО меняет хозяина на 8–10 сутки от начала болезни. Эта же норма реакции определяет клинические проявления болезни, вызванной случайными для позвоночного хозяина паразитами фагоцитирующих клеток (возбудители чумы, туляремии, мелиоидоза, сибирской язвы; см. подглаву 2.2). Но их поддержание в природе не зависит от сохранения жизни такому хозяину. Отсюда низкие инфицирующие дозы, высокая смертность среди заболевших людей (животных) и попытки использования таких микроорганизмов в качестве агентов биологического оружия. Поэтому та патогенность (вирулентность) микроорганизма, которая характеризуется в нашем восприятии времени быстрым инкубационным периодом и непродолжительной болезнью, завершающейся либо гибелью организма, либо его выздоровлением, — это проявление определенной стратегии паразитизма микроорганизма в многоклеточном хозяине. Условно назовем ее первой стратегией паразитизма, или стратегией мора. Антропонозному (зоонозному) паразиту стратегия первого типа дает преимущества в высокоплотных популяциях хозяина.
|
|||||||||
|
Последнее изменение этой страницы: 2021-02-07; просмотров: 73; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.102.112 (0.032 с.) |