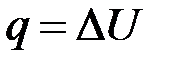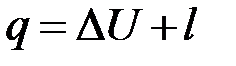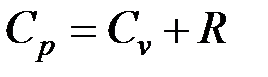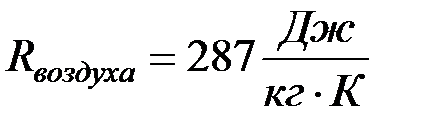Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнение состояния идеального газа полученное на основе мкт
Уравнение состояния идеального газа в термодинамике. За долго до того как уравнение состояния идеального газа было теоретически получено в молекулярной физике закономерности между температурой, давлением и объёмом были хорошо изучены экспериментально: в 1834г французский физик Клапейрон в результате обобщения экспериментальных законов Бойля-Марриотта, Гей-Люсака и Шарля получил уравнение состояния для газов близких по свойствам к идеальным, уравнение устанавливает что для данной массы газа отношение объёма и давления к абсолютной температуре – есть величина постоянная. R’ – удельная газовая постоянная значение которой индивидуально для каждого газа и приводится в справочнике. Для практического использования уравнение записывают следующим образом: В 1874г Д.И.Менделеев на основе уравнения Клапейрона и закона Авагадро вывел уравнение состояния которое не содержит индивидуальной постоянной для каждого газа.
Лекция №8 Теплоёмкость Теплоёмкость – это количество теплоты, которое требуется подвести или отнять от тела для изменения его температуры на один градус, обозначается С, измеряется в [
Отсюда можно определить количество теплоты Q, которое требуется подвести к телу, для изменения его температуры на необходимое количество градусов.
Значение теплоёмкости индивидуально для каждого вещества, определено экспериментальным путём и приводится в справочниках. Теплоёмкость зависит от: 1) Характера процесса при котором подводится или отводится теплота · CV – теплоёмкость определяемая при растущем объёме. · Cp – теплоёмкость определяемая при растущем давлении. 2) Температуры тела: в практических инженерных расчётах данная зависимость приходится учитывать. Количество подведенной теплоты в процессе рассчитывается по формуле:
В предварительных расчётах среднее значение теплоёмкости в данном температурном диапазоне, то есть она принимается постоянной.
В зависимости от способа задания количества вещества используют теплоёмкости: · Удельная теплоёмкость (C
· Объёмная теплоёмкость (C’ · Молярная теплоёмкость ( Рассмотрим процессы подведения теплоты, происходящие при: 1. В изохорном процессе вся подводимая теплота идёт только на увеличение внутренней энергии (температуры).
2. В процессе с постоянным давлением часть теплоты пошла на увеличение внутренней энергии (температуры), а часть теплоты пошла на совершение работы равной: (работа изменения объёма)
Таким образом, в изобарном процессе с подвижным поршнем, потребовалось большее количество теплоты для изменения температуры на один градус, на величину энергии соответствующую совершенной работе. Связь между изохорной и изобарной теплоёмкостями устанавливает уравнение Маера:
Из данного уравнения хорошо виден смысл газовой постоянной R. Физический смысл газовой постоянной заключается в том, что она численно равна работе совершаемой газом при нагревании его на один градус при росте давлении.
Политропный процесс – это термодинамический процесс, который объединяет в себе изопроцессы, а так же промежуточные процессы. При политропном процессе остаётся постоянная теплоёмкость. Уравнение политропы имеет вид:
Где n – показатель политропного процесса.
Примеры политропных процессов: 1. Изобарный 2. Изохорный 3. Изотермический 4. Адиабатный
Лекция №9 Второй закон термодинамики
|
|||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 29; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.219.208.117 (0.006 с.) |
 ]
] 
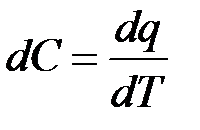
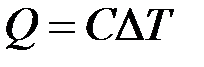


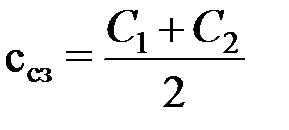

 ,C
,C  ) – показывает какое количество тепла необходимо подвести к одному килограмму вещества для изменения его температуры на один градус.
) – показывает какое количество тепла необходимо подвести к одному килограмму вещества для изменения его температуры на один градус. ,C’
,C’  ) – показывает какое количество тепла необходимо подвести к одному метру кубическому вещества для изменения его температуры на один градус.
) – показывает какое количество тепла необходимо подвести к одному метру кубическому вещества для изменения его температуры на один градус. C
C  C
C