
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вычисление изменения рн буферных растворов, вызванных добавлением кислоты или щелочи
Задача №2. Для экспериментального определения содержания ионов Решение. 1. рН исходной смеси растворов 2. При добавлении к буферному раствору 0,1 М 3. При добавлении же 0,1 М 4. При разбавлении буферного раствора водой в 10 раз будем иметь: Ответ. 1) Вычисление соотношения объемов компонентов буферной системы с определенным рН Задача №3. Вычислите объем раствора натрий формиата с Решение. 8. Из формулы расчета рН: 9. С учетом того, что 10. 11. Находим нужный объем кислоты и соли: Ответ. Вычисление буферной ёмкости Задача №4. К 100 мл к ротовой жидкости для изменения рН от 7,8 до 7,4 надо добавить 3,6 мл HCl Решение. 8. Буферную ёмкость
Ответ. 1.2. Ситуационные задачи (№№ с 5 по 14) для закрепления материала (выполнить в протокольной тетради). Задача №5. Раствор формальдегида способен придавать тканям упругость и поэтому его применяют для консервации анатомических и биологических препаратов. Но при длительном хранении этого раствора происходит окислительно-восстановительная реакция, в результате чего образуются молекулы метилового спирта и муравьиной кислоты. Для нейтрализации кислоты используется фосфатный буферный раствор. Рассчитайте значение рН буферной смеси, содержащей в 1 л раствора 0,10 моль
Задача №6. Каков рН буферного раствора, приготовленного смешением 20 мл 0,2М раствора Задача №7. Вычислить рН раствора, полученного путем смешивания 20 мл 0,05 М раствора азотистой кислоты Задача № 8. Определите рН буферного раствора, содержащего в 1 л 0,4 моль муравьиной кислоты и 1,0 моль формиата натрия, до разбавления и после разбавления в 50 раз, если Задача №9. Гидрокарбонатная буферная система обеспечивает 80% буферных свойств слюны, а повышенные потери Задача № 10. рН ротовой жидкости в норме 5,8-7,5, а при нарушениях кислотно-щелочного равновесия может изменяться в пределах 4,5-8,3. При каких соотношениях количеств Задача №11. Буферный раствор приготовлен из 50 мл 0,3 М раствора Задача № 12. К 100 мл ротовой жидкости для изменения рН на единицу надо добавить 1,8 мл 0,2 М раствора HCl. Какова буферная ёмкость ротовой жидкости по кислоте? Задача №13. Сколько щелочи нужно добавить к 1 мл десневой жидкости, чтобы изменить их рН от 7,9 до 8,3, если буферная ёмкость белкового буфера 0,034 моль/л? Задача №14. Буферная ёмкость раствора по основанию равна 45 ммоль/л. Вычислите, какой объем раствора гидроксида натрия с молярной концентрацией 0,1 моль/л можно добавить к 250 мл этого раствора, чтобы сместить рН не более чем на 0,3 единицы?
Контрольные вопросы и задачи 9. Что выполняет роль слабой кислоты в фосфатном буфере: гидрофосфат или дигидрофосфат? 10. Почему при выводе формул рН буферных растворов равновесную концентрацию слабых электролитов можно принять за исходную? 11. Докажите, что небольшое разбавление практически не влияет на рН буферных систем. 12. Почему максимальная буферная ёмкость наблюдается при соотношении компонентов 1:1? 13. Почему буферная ёмкость по кислоте и по щелочи не всегда совпадает? 14. Какая буферная система вносит максимальный вклад в буферную ёмкость ротовой жидкости и крови? 15. Как используется уравнение Гендерсона–Гассельбаха при оказании помощи пациентам с отравлениями? 16. При введении в раствор формиата аммония: ионов а) 17. Какое соотношение 18. При подъеме в горы наблюдается гипервентиляция легких. Какое нарушение кислотно-основного гомеостаза при этом возможно? 19. Что такое алкалоз и ацидоз и как изменяется рН при выдохе? 20. Какова должна быть концентрация ацетата натрия в 0,01 М растворе уксусной кислоты, чтобы концентрация ионов 21. Какую из кислот: 22. Для приготовления трех буферных растворов использовали 1,0 М растворы гидрофосфата и дигидрофосфата натрия, смешав их в соотношениях: а) 8:2; б)5:5; в) 3:7. У какого раствора будет максимальная буферная ёмкость и наибольшее значение рН? 23. Рассчитайте величину буферной ёмкости фосфатного буферного раствора, если после добавления 10 мл 24. Во сколько раз концентрация водородных ионов в крови (рН=7,36) больше, чем в спинномозговой жидкости (7,53)? Экспериментальная часть Лабораторная работа. Определение буферной ёмкости
|
||||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 651; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.200.211 (0.015 с.) |
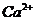 в образце консервированной крови методом комплексонометрии, необходимо приготовить аммиачный буфер с рН 8-10. Однако данное значение не должно быть выше 10,т.к. в этом случае выпадает осадок гидроксида металла. Вычислите рН аммиачной буферной системы, содержащей по 0,5 М гидроксида аммония
в образце консервированной крови методом комплексонометрии, необходимо приготовить аммиачный буфер с рН 8-10. Однако данное значение не должно быть выше 10,т.к. в этом случае выпадает осадок гидроксида металла. Вычислите рН аммиачной буферной системы, содержащей по 0,5 М гидроксида аммония 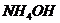 и хлорида аммония
и хлорида аммония 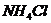 . Как изменится рН при добавлении к 1 л этой смеси 0,1 М
. Как изменится рН при добавлении к 1 л этой смеси 0,1 М 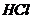 и при добавлении к 1 л этой смеси 0,1 М
и при добавлении к 1 л этой смеси 0,1 М 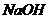 и при разбавлении раствора водой в 10 раз, если
и при разбавлении раствора водой в 10 раз, если 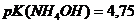 ?Правильно ли приготовлен буферный раствор?
?Правильно ли приготовлен буферный раствор?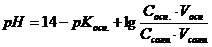 . Следовательно,
. Следовательно, 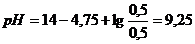 .
.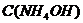 уменьшится на 0,1 М и станет равной 0,4 М, а С(
уменьшится на 0,1 М и станет равной 0,4 М, а С(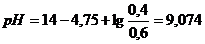 .
.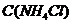 уменьшится до 0,4 М, в результате этого получим:
уменьшится до 0,4 М, в результате этого получим: 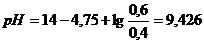 .
.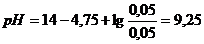 .
.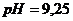 (исходной смеси); 2)
(исходной смеси); 2) 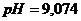 (при добавлении
(при добавлении 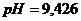 (при добавлении
(при добавлении 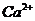 (или
(или  ) около 9.
) около 9.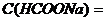 0,1 моль/л и объем муравьиной кислоты
0,1 моль/л и объем муравьиной кислоты 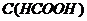 =0,1 моль/л, которые необходимы для приготовления 2 л формиатного буфера с рН=3,15 (
=0,1 моль/л, которые необходимы для приготовления 2 л формиатного буфера с рН=3,15 (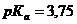 ).
).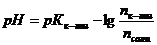 следует:
следует: 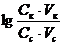
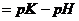 .
.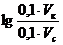
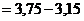 =0,60, получаем:
=0,60, получаем: 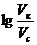 =0,60.
=0,60.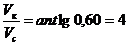 . Следовательно, необходимо 4 части раствора кислоты и одну часть раствора соли для приготовления буферной системы с рН=3,15.
. Следовательно, необходимо 4 части раствора кислоты и одну часть раствора соли для приготовления буферной системы с рН=3,15.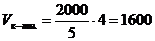 мл,
мл, 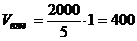 мл.
мл.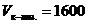 мл;
мл; 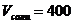 мл.
мл.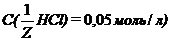 , какова буферная ёмкость
, какова буферная ёмкость 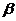 этой жидкости?
этой жидкости?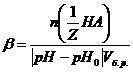 =
= 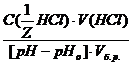 =
= 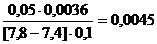 моль/л.
моль/л.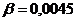 моль/л.
моль/л.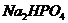 и 0,30 моль
и 0,30 моль 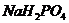 . Константа диссоциации ортофосфорной кислоты Н3РО4 по второй ступени равна
. Константа диссоциации ортофосфорной кислоты Н3РО4 по второй ступени равна 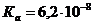 ;
; 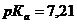 .
. . рКа (СН3СООН)=4,74.
. рКа (СН3СООН)=4,74.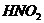 и 30 мл 1,5 М раствора нитрита натрия
и 30 мл 1,5 М раствора нитрита натрия  .
.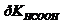 = 3,75.
= 3,75.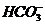 , ограничение выведения
, ограничение выведения 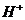 и
и 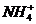 ведут к развитию метаболического ацидоза. Каково соотношение бикарбоната натрия и угольной кислоты в ротовой жидкости, рН которой=7,4, если суммарный
ведут к развитию метаболического ацидоза. Каково соотношение бикарбоната натрия и угольной кислоты в ротовой жидкости, рН которой=7,4, если суммарный 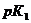 в слюне 6,11?
в слюне 6,11?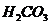 /
/ 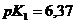 / и 40 мл 0,5 М раствора
/ и 40 мл 0,5 М раствора 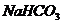 . а) Определите рН этого буферного раствора. б) Как изменится рН, если к этому раствору прибавить 10 мл 0,2 М
. а) Определите рН этого буферного раствора. б) Как изменится рН, если к этому раствору прибавить 10 мл 0,2 М 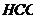 ? в) Рассчитайте буферную емкость по кислоте.
? в) Рассчитайте буферную емкость по кислоте.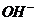 протекают следующие процессы: а)
протекают следующие процессы: а) 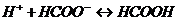 ; б)
; б) 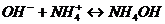 . Будет ли раствор
. Будет ли раствор 
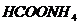 проявлять буферные свойства?
проявлять буферные свойства? и
и 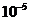 моль/л?
моль/л?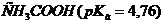 ,
, 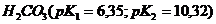 ,
, 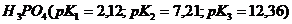 лучше выбрать для приготовления буферного раствора с наибольшей буферной ёмкостью и с рН= 7,45? Как приготовить 100 мл такого раствора из 1 М растворов компонентов?
лучше выбрать для приготовления буферного раствора с наибольшей буферной ёмкостью и с рН= 7,45? Как приготовить 100 мл такого раствора из 1 М растворов компонентов? =0,5 моль/л к 20 мл этого раствора рН последнего увеличивается с 7,2 до 8,0.
=0,5 моль/л к 20 мл этого раствора рН последнего увеличивается с 7,2 до 8,0.


