
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Давление насыщенного пара растворителя
Давление пара над раствором нелетучего вещества в каком-либо растворителе всегда ниже, чем над чистым растворителем при одной и той же температуре. Согласно закону Рауля (I закон ), относительное понижение давления насыщенного пара растворителя над идеальным раствором нелетучего вещества равно молярной доле растворенного вещества:
Þ Þ Þ Число молей растворенного вещества и растворителя можно находить по формулам: Þ Отсюда можно найти: Таким образом, относительное понижение давления пара растворителя над раствором (или депрессия раствора) зависит только от концентрации раствора, но не зависит от температуры. Для разбавленных растворов Закон Рауля точно соблюдается только для идеальных растворов и приближенно для разбавленных реальных растворов: чем разбавленнее раствор, тем более он приближается к идеальному. 2.2. Температура кипения и замерзания растворителя и раствора (II закон Рауля) Изучая кипение и замерзание растворов, Рауль (1882) установил, что повышение температуры кипения и понижение температуры замерзания разбавленных растворов неэлектролитов пропорционально моляльности растворов. Эта закономерность называется вторым законом Рауля и его математическим выражением являются уравнения:
Постоянные константы
На измерениях температур кипения и замерзания основаны эбуллиоскопический и криоскопический методы определения молекулярных масс веществ:
Второй закон Рауля иногда называют следствием первого. Ряд ученых подразделяют все закономерности, установленные Раулем на три закона: 1. тоноскопический (понижение давления пара над раствором); 2. криоскопический (понижение температуры замерзания раствора); 3. эбуллиоскопический (повышение температуры кипения раствора). В целом, обобщенные формулы для разбавленных растворов электролитов и неэлектролитов имеют вид:
Задача №1. Применение соединений цинка в медицине основано на том, что цинк дает соединения с белками – альбуминаты растворимые и нерастворимые, последние обычно образуют пленку на тканевой поверхности и оказывают подсушивающее действие, что способствуют заживлению тканей, а растворимые оказывают действие от слабовяжущего до резко прижигающего. Осмотическое давление 0,1 М. ZnSO4 при 0°С равно Решение. 1. Для растворов электролитов применяем формулу: 2. Соль 3. Согласно (3) Ответ. Задача №2. Определить концентрацию раствора глюкозы, если раствор этого вещества при 18°С изотоничен с раствором, содержащим 0,5 моль/л хлорида кальция. Кажущаяся степень диссоциации СаCI2 в растворе при указанной температуре составляет 65,4%. Решение. 1. Согласно (1) и (2) 2. Так как оба раствора изотоничны, то 3. При диссоциации молекулы соли 4. Согласно формуле (3): Ответ. Задача № 3. В медицине раствор формальдегида применяется для консервации анатомических и биологических препаратов и не может быть назначен внутрь, т.к. является протоплазматическим ядом. Определить температуру кипения раствора, содержащего 6 г формальдегида
Решение. 1. Согласно закону эбулиоскопии(Рауля): 2. Тогда Ответ. Задача №4. По фармакологическим свойствам этиловый спирт относится к веществам наркотического действия. Воздействуя на кору головного мозга, он вызывает характерное алкогольное возбуждение, в больших дозах – ослабление возбудительных процессов коры и угнетение деятельности дыхательного центра. При какой примерно температуре будет замерзать 40 % водный раствор Решение. 1. Из формулы закона криоскопии (Рауля): 2. Отсюда: Ответ. Раствор начнет замерзать примерно при 1.2. Ситуационные задачи №№5, 6, 7,8 для закрепления материала (выполнить в протокольной тетради). Задача №5. В медицинской практике для компенсации больших потерь крови больному вводят физиологический раствор. Рассчитайте массовую долю (в %) NaCI (с точностью до целых) в физиологическом растворе, осмотическое давление которого при 25оС составляет 762,7 кПа (α=1, ρ=1 г/см3). Задача №6. С медицинской целью камфору применяют натуральную правовращающую, добываемую из камфорного дерева, либо синтетическую левовращающую, полученного из пихтового масла, либо рацемическую. Криоскопическая постоянная камфоры равна 40,27 оС. 0,0113 г фенантрена понизили точку замерзания 0,0961 г камфары на 27,0 оС. Найдите молярную массу фенантрена в камфоре. Задача №7. В медицинской практике фруктозуприменяют при лечении белой горячки и американскими учеными предложено ее вводить в состав «отрезвляющих» препаратов, т.к. фруктоза, применяемая в дозе 1 г на кг массы тела одновременно с алкоголем, увеличивает скорость его выведения из организма на 10%, а принимаемая через час – на 20-30%. Вычислите температуру кипения и замерзания 5% водного раствора фруктозы. Задача №8. Бензол используется для синтеза поверхностно-активных веществ, в том числе большое количество фармацевтических препаратов. Вычислите давление насыщенного пара над раствором бензола (Mr=78 г/моль), в 83 г которого содержится 12,8 г нафталина - С10Н8 ( Контрольные задачи 1. В каком из растворов хлорида натрия: 2%, 0,86%, 0,2% жизнедеятельность эритроцитов не будет нарушена и почему? 2. Изотоничны ли растворы мочевины и уксусной кислоты с массовой долей 0,6%, если степень диссоциации уксусной кислоты равна 0,01, ρ =1 г/мл? 3. Магния сульфат / 4. Никотинамид (пиридин-3-карбоновой кислоты) в медицинской практике применяют как специфическое противоаллергическое средство. Осмотическое давление крови при 37оС равно 7.7 атм. Будет ли изотоничен крови 2% раствор никотинамида /
5. Общая осмотическая концентрация в плазме крови в норме составляет 0,3 моль/л. Вычислите осмотическое давление плазмы крови при T=25oC. 6. Осмотическое давление раствора, содержащего 0,2 г белка в 10 мл, при 25оС равно 10-3 атм. Определить молярную массу белка. 7. Рассчитайте осмотическое давление 20%-ного водного раствора глюкозы (ρ = 1,08 г/мл) при 310 К, применяемого для внутривенного введения, например, при отеке легкого. Каким будет этот раствор (гипо-, гипер-, изотоническим) по отношению к крови, если учесть, что π крови равно 740-780 кПа? 8. Чему равно осмотическое давление раствора при 20оС, в 100 мл которого содержится 6,33 г красящего вещества крови – гематина (Mr (С34Н33N4O5Fe=633 г/моль))?. 9. Что произойдет с эритроцитами крови, если их поместить в 3 моль/л раствор глюкозы? 10. Что произойдет с эритроцитами при 310 К в 2%-ном растворе глюкозы (ρ=1,006 г/мл) 11. В каком из двух растворов глюкозы отклонение от закона Рауля будет больше: с С=0,1М или С=0,2М? Дайте пояснения. 12. В каком случае отклонение от закона Рауля будет больше: в растворе уксусной кислоты с моляльной концентрацией 0,05 моль/кг или в соляной кислоте с такой же моляльной концентрацией? Дайте пояснения. 13. Вычислите температуру кипения и температуру замерзания 4,6% раствора глицерина в воде. 14. Вычислите температуру кипения и температуру замерзания водного раствора сахарозы с массовой долей 2%. 15. Давление пара чисто 16. Определите эбулиоскопическую постоянную ацетона, если раствор, содержащий 4,6 г глицерина / 17. Температура замерзания сыворотки крови равна -0,56оС. Рассчитайте моляльную концентрацию солей в крови, условно считая все соли бинарными и полностью распадающимися на ионы по схеме: Экспериментальная часть Лабораторная работа. Определение молярной массы неэлектролита Криоскопическим методом Принцип метода. В основе криоскопического метода определения молекулярной массы вещества лежит закон Рауля, причем он справедлив для сильно разбавленных растворов неэлектролитов. При затвердевании такого раствора сначала выпадают кристаллы чистого растворителя, и раствор становится более концентрированным, а температура кристаллизации – наиболее низкой. Поэтому при определении температуры затвердевания раствора следует измерять температуру начала кристаллизации. При этом нельзя допускать сильного переохлаждения раствора (более чем на
Криоскопический метод является более точным, чем эбуллиоскопический, так как в этом случае не происходит потери растворителя путем испарения, криоскопическая постоянная воды больше эбуллиоскопической, что повышает точность отсчетов при определении ∆ Цель работы. Научиться методом криоскопии определять молярную массу растворенного вещества. Приборы и оборудование: криометр, дифференциальный термометр Бекмена, термометр химический. Реактивы: лед колотый или снег, хлорид натрия (крист.), навеска исследуемого вещества (сахароза С12Н22О11); вода дистиллированная. Ход работы: 1. Заполните внешний сосуд криометра (см. рисунок 3.1), т.е. стакан / 4/ охладительной смесью из воды, льда и технической соли
2. Отмерьте из бюретки в сосуд / 3/, или взвесьте на аналитических весах, ≈ 20,00 см3 растворителя / 3. Настройте термометр Бекмана / 1 / и вставьте в прибор в вертикальном положении, он не должен касаться стенок сосуда. После настройки данный термометр нельзя класть горизонтально и встряхивать, чтобы из капилляра в верхний резервуар не упала капелька ртути. 4. Медленно помешивайте жидкость до температуры на 0,5оС выше ожидаемой температуры кристаллизации, затем, прекратив помешивание, наблюдайте за понижением температуры (для чистого растворителя до –0,5- –1,0оС). 5. Возобновите перемешивание переохлажденной жидкости, что вызовет кристаллизацию и повышение температуры. Не прекращая перемешивания, отмечайте максимальную температуру подъема (из переохлажденного состояния), которая и будет истинной температурой кристаллизации данной жидкости. 6. Выньте сосуд / 3/ из стакана / 4/ и, подогревая его рукой, растворите образовавшиеся кристаллы. 7. Опустите сосуд / 3/ снова в стакан / 4/ и повторите переохлаждение с последующей кристаллизацией. Опыт повторите несколько раз, пока последние два определения температуры кристаллизации будут отличаться не более чем на 0,01оС. 8. Определив температуру кристаллизации растворителя, через боковой тубус сосуда / 3/, всыпьте навеску исследуемого вещества и, вынув сосуд с веществом и растворителем, подогрейте его рукой, вызывая расплавление кристаллов растворителя и растворение в нем навески.
9. Вставив сосуд в стакан /4/, проведите процесс охлаждения так же, как это предписано выше в пп. 3-5. (Раствор переохлаждать более чем на 0,2 оС нельзя). 10. Все вышеуказанные данные и результаты опыта внесите в таблицу № 3.1. 11. Отчет о работе состоит из непосредственной записи наблюдений и вычислений по ниже указанной форме. а) Температуру кристаллизации раствора определите 3–4 раза; из полученных данных рассчитайте среднюю температуру кристаллизации / б) Рассчитайте молярную массу растворенного вещества по формуле: где Таблица №3.1
|
|||||||||||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 676; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.115.120 (0.054 с.) |
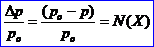 , где
, где -давление пара над чистым растворителем, Па;
-давление пара над чистым растворителем, Па; 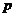 - давление пара растворителя над раствором нелетучего вещества, Па; /
- давление пара растворителя над раствором нелетучего вещества, Па; / 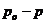 /– абсолютное понижение давления пара над раствором, Па. Величина
/– абсолютное понижение давления пара над раствором, Па. Величина 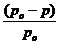 - относительное понижение давления пара над раствором.
- относительное понижение давления пара над раствором.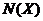 - молярная доля растворенного вещества (Х), которая определяется по формуле:
- молярная доля растворенного вещества (Х), которая определяется по формуле:  , где
, где 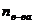 - число молей растворенного вещества;
- число молей растворенного вещества; 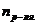 - число молей растворителя. Величина
- число молей растворителя. Величина 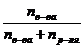 – мольная доля растворенного вещества.
– мольная доля растворенного вещества.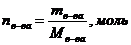 или
или  .
. и
и 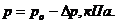
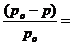
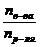 .
.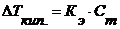
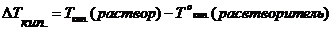
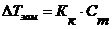

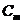 - моляльность раствора;
- моляльность раствора;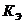 - эбуллиоскопическая постоянная растворителя (от лат. «ebbulire» — выкипать);
- эбуллиоскопическая постоянная растворителя (от лат. «ebbulire» — выкипать);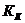 - криоскопическая постоянная растворителя (от греч. «криос» - холод);
- криоскопическая постоянная растворителя (от греч. «криос» - холод);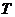 - температура кипения и замерзания раствора;
- температура кипения и замерзания раствора; – температура кипения и замерзания чистого растворителя.
– температура кипения и замерзания чистого растворителя.

 Для растворов неэлектролитов
Для растворов неэлектролитов
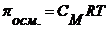 2.
2. 
 4.
4.  2.
2. 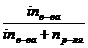 3.
3. 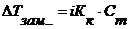 4.
4. 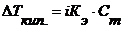
 Па. Определить кажущуюся степень диссоциации соли в данном растворе.
Па. Определить кажущуюся степень диссоциации соли в данном растворе.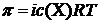 , из которой находим изотонический коэффициент:
, из которой находим изотонический коэффициент: 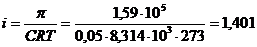 .
.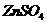 при диссоциации образует 2 иона (К=2).
при диссоциации образует 2 иона (К=2).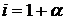 , отсюда
, отсюда 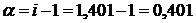 или
или  .
.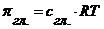 , а
, а  .
. .
.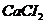 образуется 3 иона (К=3),
образуется 3 иона (К=3), 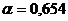 .
.
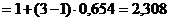 . Следовательно,
. Следовательно, 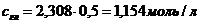 .
. моль/л.
моль/л.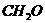 в 100 г воды.
в 100 г воды. 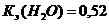 град∙кг/моль.
град∙кг/моль.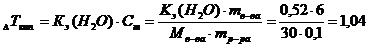 град.
град.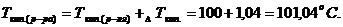

 .
.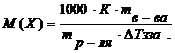 , следует:
, следует: 
 .
. .
.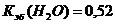 К∙кг/моль,
К∙кг/моль, 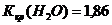 К∙кг/моль.
К∙кг/моль.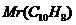 = 128 г/моль), если давление насыщенного пара бензола при 20оС равна 100 кПа.
= 128 г/моль), если давление насыщенного пара бензола при 20оС равна 100 кПа.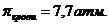 , T=37оС. Плотность растворов и степень диссоциации NaCI считать равными единице.
, T=37оС. Плотность растворов и степень диссоциации NaCI считать равными единице.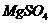 / в медицинской практике применяют как слабительное, желчегонное и успокаивающее действие на ЦНС. При концентрации препарата в крови 9-10 мг% наступает снотворный эффект, а при 15-18 мг% – наркотическое состояние. Большие концентрации могут вызвать угнетение дыхания. Определите осмотическое давление раствора сульфата магния концентрации 0,005 моль/л при 18оС, если кажущаяся степень диссоциации этой соли равна 66%.
/ в медицинской практике применяют как слабительное, желчегонное и успокаивающее действие на ЦНС. При концентрации препарата в крови 9-10 мг% наступает снотворный эффект, а при 15-18 мг% – наркотическое состояние. Большие концентрации могут вызвать угнетение дыхания. Определите осмотическое давление раствора сульфата магния концентрации 0,005 моль/л при 18оС, если кажущаяся степень диссоциации этой соли равна 66%. (витамин РР), ρ=1,03 г/мл?
(витамин РР), ρ=1,03 г/мл? го ацетона при 20°С 23940 Па. Давление пара раствора камфоры в ацетоне, содержащего 5 г камфоры на 200 г ацетона при той же температуре, равно 23 710 Па. Определить молекулярную массу камфоры, растворенной в ацетоне.
го ацетона при 20°С 23940 Па. Давление пара раствора камфоры в ацетоне, содержащего 5 г камфоры на 200 г ацетона при той же температуре, равно 23 710 Па. Определить молекулярную массу камфоры, растворенной в ацетоне.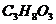 / в 200 г ацетона /
/ в 200 г ацетона / 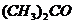 /, кипит при температуре 56,43оС. Ткип(
/, кипит при температуре 56,43оС. Ткип(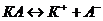 . Наличие в сыворотке неэлектролитов во внимание не принимать.
. Наличие в сыворотке неэлектролитов во внимание не принимать.  К∙кг/моль.
К∙кг/моль.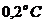 ).
). . В криоскопическом методе точность определения молекулярной массы зависит от точности измерения температуры. Для этого пользуются специальным термометром Бекмана (см. рисунок 3.1(а)), предназначенным для измерения малых разностей температур.
. В криоскопическом методе точность определения молекулярной массы зависит от точности измерения температуры. Для этого пользуются специальным термометром Бекмана (см. рисунок 3.1(а)), предназначенным для измерения малых разностей температур.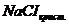 (40-50 г) с температурой на 3–4о ниже 0оС, закройте его крышкой со вставленной в нее мешалкой /5/ и сосудом / 3/.
(40-50 г) с температурой на 3–4о ниже 0оС, закройте его крышкой со вставленной в нее мешалкой /5/ и сосудом / 3/.
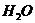 /.
/.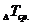 / и разность средних температур кристаллизации растворителя, раствора
/ и разность средних температур кристаллизации растворителя, раствора 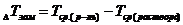 .
.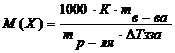 ,
, – масса растворенного вещества, г;
– масса растворенного вещества, г; 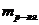 - масса растворителя (воды, г).
- масса растворителя (воды, г).


