
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Вычисления по результатам прямого титрования
Задача №7. В медицине кислоту хлористоводородную разведенную применяют внутрь в каплях или в виде микстуры (чаще вместе с пепсином) при недостаточной кислотности желудочного сока и ее обычно назначают совместно с препаратами железа, так как она способствует улучшению их всасывания. Какова молярная концентрация эквивалента и титр хлороводородной кислоты, если на нейтрализацию 20 мл ее раствора по реакции Эталон решение. 1. Из формулы закона эквивалентов: 2. Определяем титр раствора HCI по формуле: Ответ. 1.2. Ситуационные задачи (№№ с 8 по 16) для закрепления материала (выполнить в протокольной тетради). Задача №8. Больному массой 59 кг необходимо ввести раствор NaHCO3 из расчета 0,66 ммоль/кг. Сколько мл раствора с массовой долей 4,2% необходимо взять? Задача №9. Для лечения гнойных ран, а также для полосканий и смазываний при воспалительных заболеваниях слизистых оболочек (стоматиты, ангина) фармацевтом был приготовлен раствор из 5 мл 30% раствора Н2О2 и 15 мл дистиллированной воды. Рассчитайте массовую долю Н2О2 в полученном растворе (ρ=1 г/мл). Задача №10. Фармакопейным препаратом перекиси водорода является раствор перекиси водорода, содержащий 2,7-3,3 % Н2О2 и этот препарат готовят из более концентрированного раствора, содержащего 27,5-31,0% Н2О2 называемого пергидролем. Рассчитайте массу Н2О2 и объем воды, необходимые для приготовления 100 г 3% раствора Н2О2. Задача № 11. Сколько миллилитров 30% (ρ=1,15 г/мл) раствора соляной кислоты надо взять для приготовления 0,5 л 8,4% фармакопейного препарата HCI (ρ=1,041 г/мл)? Задача №12. Раствор Люголя, применяющийся в ЛОР- практике для смазывания слизистой оболочки полости рта и горла, содержит 17 мл воды, 1 г йода, 2 г йодида калия. Рассчитать массовые и молярные доли йода и йодида калия в растворе Люголя. Задача №13. Какую массу глюкозы необходимо растворить в воде массой 260 г, чтобы получить раствор, моляльность которого Сm (С6H12O6/H2O)= 0,5 моль/кг? Задача №14. Растворы
Задача №15. Для стандартизации раствора хлороводородной кислоты навеску буры (Na2B4O7∙10H2O) массой 0,256 г растворили в мерной колбе объемом 100 мл. На титрование затрачено 13,16 мл раствора HCl. Вычислите молярную концентрацию эквивалента раствора хлороводородной кислоты. 1.3. Контрольные вопросы и задачи 1. Что такое раствор? Какие свойства воды делают ее универсальным растворителем? 2. Какими энергетическими эффектами сопровождается процесс растворения веществ? 3. Что называется парциальным давлением газа? Дайте формулировку закона парциальных давлений Дальтона. 4. Объясните характер изменения растворимости газов в жидкостях при изменении парциального давления газов и температуры системы. Приведите примеры. Что такое кессонная болезнь (для ответа см. приложение 2 и 3). 5. Дайте определение, укажите размерность и обозначение каждого из следующих типов концентраций: молярная концентрация, эквивалентная молярная концентрация (нормальность), моляльность (мольно-массовая концентрация). 6. В чем заключается сущность процесса титрования? Что такое точка эквивалентности? 7. Для чего при титровании применяются индикаторы? Какие индикаторы вы знаете? 8. Рассчитайте молярную массу эквивалента для серной кислоты, фосфорной кислоты, гидроксида калия, сульфата алюминия, карбоната натрия, хлорида меди (II), сульфата меди (II). 9. Какой массы медный купорос 10. Какая масса кристаллогидрата 11. Определить молярную концентрацию эквивалента и титр раствора пероксида водорода, если на титрование 5,0 мл этого раствора израсходовалась 6.5 мл 0,0208 М раствора КMnO4. Экспериментальная часть
Лабораторная работа. Кислотно-основное титрование (нейтрализация)
|
||||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 103; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.8.127 (0.008 с.) |
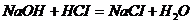 израсходовано 30 мл раствора гидроксида натрия С
израсходовано 30 мл раствора гидроксида натрия С 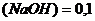 моль/л
моль/л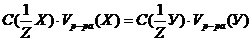 , следует:
, следует: 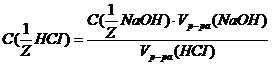 =
= 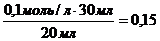 моль/л.
моль/л.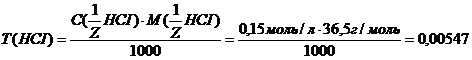 г/мл.
г/мл.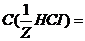 0,15 моль/л;
0,15 моль/л; 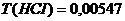 г/мл.
г/мл.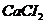 в медицинской практике применяют как противоядие при отравлениях: солями магния, щавелевой кислотой и ее растворимыми солями, а также растворимыми солями фтористой кислоты, т.к. при этом образуются недиссоцирующие и нетоксичные соединения: оксалат и фторид кальция. Сколько граммов 10% раствора хлорида кальция /
в медицинской практике применяют как противоядие при отравлениях: солями магния, щавелевой кислотой и ее растворимыми солями, а также растворимыми солями фтористой кислоты, т.к. при этом образуются недиссоцирующие и нетоксичные соединения: оксалат и фторид кальция. Сколько граммов 10% раствора хлорида кальция / 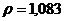
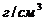 / потребуется для приготовления 20 мл 2% раствора /
/ потребуется для приготовления 20 мл 2% раствора / 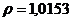
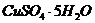 надо добавить к раствору объемом 0,5 л, в котором массовая доля
надо добавить к раствору объемом 0,5 л, в котором массовая доля 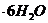 потребуется для приготовления раствора массой 1750 г, если его моляльность должна быть равна 0,2 моль/кг?
потребуется для приготовления раствора массой 1750 г, если его моляльность должна быть равна 0,2 моль/кг?


