
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Правила работы в химической лабораторииСтр 1 из 17Следующая ⇒
С.А. Сергеева, В.Е. Рябинин
Концентрация растворов Коллигативные свойства растворов Водородный показатель. Гидролиз солей. Буферные растворы
Учебное пособие предназначено для самостоятельной аудиторной и внеаудиторной работы студентов, обучающихся по специальности 060105.65 – Стоматология
Челябинск 2012 УДК ББК
Представлены практические задания по избранным разделам неорганической, аналитической и физической химии с учетом физико-химических проблем, имеющих отношение к профессиональной деятельности врача-стоматолога. По каждой изучаемой теме приведены: её содержание, ситуационные задачи с образцами их решения и задания для самостоятельной работы студентов, а также темы реферативных докладов с медико-биологической направленностью. В пособии подробно описаны методики выполнения лабораторных работ, а также физико-химические принципы проведения эксперимента и обработки результатов измерений, что повышает профилизацию предмета. После каждой лабораторной работы приводятся тестовые задания, которые помогут студентам в освоении изучаемой темы. В конце пособия приведены справочные данные о свойствах важнейших неорганических соединений. Пособие составлено с учетом требований Федерального Государственного образовательного стандарта высшего профессионального образования по специальности 060201– Стоматология, утвержденного приказом Минобрнауки РФ № 16 от 14 января 2011 года.
Учебное пособие утверждено на заседании Ученого совета ГБОУ ВПО ЧелГМА Минздравсоцразвития России от ….12 протокол №….. Учебное пособие предназначено для студентов стоматологического факультета.
Содержимое ресурса охраняется законом об авторском праве. Несанкционированное копирование и использование данного продукта без ссылки на издание запрещается.
Сергеева С.А., Рябинин В.Е., 2012 Изд-во «Челябинская государственная медицинская академия, 2012 Оглавление
Введение
Ежедневная практическая деятельность врачей, как правило, не требует использования ими фундаментальных или прикладных знаний химии, так как основывается на отработанных протоколах лечения, инструкциях по применению лекарственных средств и пр., которые в свое время были разработаны с применением в том числе законов и принципов общей и неорганической химии. В то же время, любой выход врача за пределы рутинной практики при попытке создания новых методов или средств лечения, при желании творческого осмысления лечебного процесса, в большей или меньшей степени сопряжен с необходимостью мобилизации базовых сведений из области химии. Именно поэтому изучение основ химии является объективно необходимым элементом подготовки современного врача. Настоящее учебное пособие к лабораторному практикуму по химии является важным этапом при изучении таких основных понятий как «концентрация растворов», «коллигативные свойства растворов», «водородный показатель», «гидролиз солей», «буферные растворы» и др. Знание способов выражения концентрации растворов, умение готовить растворы определенной концентрации, окажется полезным при изучении других химических дисциплин, биохимии, гигиены, фармакологии, токсикологии и др. Важное место в пособии уделяется вопросам регуляции различных биологических процессов. При этом необходимым становится усвоение таких понятий, как «осмос», «осмотическое давление», «гипо-, гипер– и изотонические растворы», «осмолярная и осмоляльная концентрация» и др. Приобретение системных знаний о механизмах электролитической диссоциации, водородном показателе (рН), гидролизе солей и буферных системах является необходимым условием для последующего усвоения принципов регуляции метаболизма человека в норме и при возникновении патологических состояний. Для более эффективного усвоения знаний в пособии разработана учебная карта занятий, включающая практическую часть с решением ситуационных задач и соответствующим контролем, экспериментальную часть и решение тестов для контроля усвоения темы.
Общие вопросы выполнения лабораторных работ Выполнение лабораторного практикума является обязательным при изучении химии, так как приобретаются навыки научного эксперимента и развивается исследовательский подход к изучению дисциплины.
Техника безопасности 1. Студент допускается к работе только после прохождения инструктажа по технике безопасности, что подтверждается подписью студента и преподавателя, проводившего инструктаж, в специальном журнале. 2. Студенты, нарушающие правила по технике безопасности, удаляются из лаборатории. Для дальнейшего прохождения практикума они должны пройти повторный инструктаж по технике безопасности и получить вновь допуск к работе. 3. Работа студента в лаборатории разрешается только во время, отведенное расписанием занятий, в исключительных случаях (пропуски по болезни) по согласованию с преподавателем в другое время, но под наблюдением преподавателя. 4. Работать в лаборатории можно только в халате. 5. В лаборатории запрещается принимать пищу, громко разговаривать, слушать музыку через наушники, заниматься посторонними делами. 6. Приступать к выполнению опыта лишь тогда, когда уяснены его цель и задачи, когда обдуманы отдельные этапы выполнения опыта. 7. Для проведения опыта не следует расходоватьреактивов больше требуемого по методике количества. Если же случайно взяли избыток реактива, то эти излишки следует отправить в отходы во избежание загрязнения реактива. Нельзя путать пробки от капельных пипеток и реактивных склянок. 8. Запах вещества определяют, направляя его пары к себе движением руки, не вдыхая их полной грудью. 9. Ни в коем случае нельзя пробовать вещества на вкус!!! 10. При работе с агрессивными веществами (кислоты, щелочи) необходимо быть внимательным и соблюдать максимальную осторожность. 11. Концентрированные кислоты, щелочи и органические растворители (эфир, бензин, бензол и др.) хранят в вытяжном шкафу и не выносят оттуда, отбор данных реагентов производится в вытяжном шкафу с помощью специально предназначенных для этого цилиндров, которые перед отбором реактива и после промываются дистиллированной водой. 12. Реакции, которые сопровождаются большим выделением тепла (приготовление растворов кислот, щелочей), проводятся только в термостойкой химической посуде в вытяжном шкафу, реакционный сосуд помещают в кристаллизатор. 13. Для набора в пипетку любых жидкостей следует использовать только грушу. 14. При разливе щелочи или органического растворителя на стол или на пол следует сразу же засыпать это место песком, песок собрать и вынести из помещения.
15. При разливе кислоты следует обработать это место содой, после чего хорошо промыть водой. 16. Растворы, не подлежащие сливу в канализацию (органические растворители, сульфиды, соли серебра и др.), следует выливать в специальные емкости в вытяжном шкафу. 17. Соблюдать правила работы с электрическими приборами (бани, плитки, центрифуги, сушильные шкафы). Нагревать растворы на электрической плитке следует в посуде из термостойкого стекла без пробки. 18. Не наклоняться над сосудом с кипящей жидкостью. Нагреваемую пробирку держать отверстием в сторону, а не к себе или соседу, так как может произойти выброс жидкости. Прогревать пробирку необходимо по всему объёму содержащегося в ней раствора, а не только снизу. 19. В случае возникновения любой опасной ситуации (возгорание, разлив агрессивных жидкостей, термические или химические ожоги, другие травмы) следует немедленно поставить в известность преподавателя, а затем предпринимать необходимые действия под его руководством. 20. Каждая лабораторная комната снабжена на случай пожара огнетушителем и ящиком с песком. Таблица 1.1 Окончание таблицы 1.1
Отравления | ||||||||||||||||||||||||||||||||||||||||
| Попадание едких веществ в рот и пищеварительные органы | При попадании кислот выпить суспензию мела или оксида магния. При попадании щелочей выпить водный раствор лимонной кислоты или 1%-ный раствор уксусной кислоты. | ||||||||||||||||||||||||||||||||||||||||
| Отравление различными ядами | Вызвать рвоту, выпив 15-25 мл 3-%-ный раствор сульфата меди (II). | ||||||||||||||||||||||||||||||||||||||||
| Отравление газами: | Пострадавшего немедленно вывести на свежий воздух. | ||||||||||||||||||||||||||||||||||||||||
Учебная карта темы.
1. Практическая часть:
1.1. Примеры решение ситуационных задач.
1.2. Вопросы и ситуационные задачи для закрепления материала.
1.3. Контрольные вопросы.
2. Экспериментальная часть (лабораторная работа).
3. Контроль усвоения темы (тесты текущего уровня).
Практическая часть
1.1.Ситуационные задачи (№№ с 1 по 7) с алгоритмами их решений, эталонами ответов и с комментариями
Экспериментальная часть
Лабораторная работа. Кислотно-основное титрование (нейтрализация)
Таблица 2.1
Таблица 2.2
Образец теста
1. Во время быстрого аварийного подъема из глубины на поверхность, в результате закупоривания кровеносных сосудов, наблюдается изменение цвета кожи, головокружение, расстройства речи, помрачения сознания и такое заболевание называется _____.
1) кессонной (декомпрессионной) болезнью
2) базедовой болезнью
3) анемией
4) диабетом
2. На растворимость твердых веществ влияет фактор _____.
1) давление
2) величина поверхности твердого вещества
3) природа растворителя
4) объем раствора
3. Для проведения клинических исследований необходимо приготовить раствор парафина и в качестве растворителя рекомендуют использовать _____.
|
|
1) воду
2) метанол
3) ацетон
4) бензол
4. Ионы, которые не могут существовать одновременно в растворе _____.
1) K+ и PO43-
2) Na+ и SO42-
3) Zn2+ и OH-
4) K+ и NO3-
5. Пергидролем называют раствор пероксида водорода с массовой долей:
1) 100 %
2) 65 %
3) 30 %
4) 3 %
6. Молярная концентрация показывает количество молей растворенного вещества, содержащееся в:
1) 1 л (или 1000 мл) раствора
2) 1000 г раствора
3) 100 г раствора
4) 100 мл раствора
7. Размерность моляльной концентрации выражается….
1) моль/кг
2) моль/л
3) г/моль
4) г/мл
8. При разбавлении серной кислоты всегда приливают кислоту в воду. Разбавление конц. H2SO4 приливанием к ней воды опасно тем, что _____.
1) может возникнуть пожар
2) может произойти разложение воды
3) может выделиться газ
4) может произойти разбрызгивание раствора вследствие выделения теплоты
9. Массовая доля раствора равна ______%, если известно, что 200 г раствора содержат 10 г сульфата цинка:
1) 2
2) 20
3) 5
4) 10
15 Массовая доля серной кислоты в конечном растворе, полученном при смешении 0,5  раствора с массовой долей
раствора с массовой долей  7% (
7% (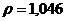
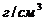 ) и 150 г этой же кислоты с массовой долей 25% составляет _____ %.
) и 150 г этой же кислоты с массовой долей 25% составляет _____ %.
1) 10
2) 11
3) 40
4) 48
10. Масса вещества и растворителя в растворе, полученном при растворении 100 г с массовой концентрацией 10% противоаллергического средства 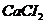 , составляет ___ и ___г.
, составляет ___ и ___г.
1) 20 и 80
2) 5 и 95
3) 10 и 90
4) 15 и 99
11. Для инъекционного введения лекарственного средства, был использован физиологический раствор 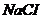 с массовой концентрацией 0,9%,
с массовой концентрацией 0,9%,  г/мл. Молярная концентрация
г/мл. Молярная концентрация 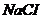 в полученном растворе составляет _____ моль/л (с точностью до целого значения).
в полученном растворе составляет _____ моль/л (с точностью до целого значения).
1) 0,16
2) 0,16
3) 0,17
4) 0,18
12. Перманганатометрию используют для определения количества органических примесей в воде. Масса перманганата калия, содержащийся в 500 мл раствора с 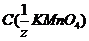 = 0,2 моль/л, составляет ______ г.
= 0,2 моль/л, составляет ______ г.
1) 1,58
2) 3,16
3) 6,32
4) 7,90
13. В медицине в качестве наружного антисептического средства используют раствор _____.
1) КМnО4
2) МnSO4
3) НСI
4) Na2SO4
4. Вопросы по теме для самостоятельного изучения их студентами. «Медицина и химия в цифрах и фактах: ошибка или заблуждения экспертов» (учебно-исследовательская самостоятельная работа с элементами проблемности). Защиту результатов предлагается проводить бригадами из 5-7 студентов.
I. Информационный раздел
На судебно-химическую экспертизу доставлена: моча пострадавшего, которая лишь один раз подвергалась клинико-лабораторному исследованию.
Обстоятельства дела. Пациент в течение 5 лет по медицинским показаниям в соответствии с назначением врача принимал комбинированный противокашлевый и отхаркивающий препарат «Коделак» по 1 таблетке 3 раза в день и назначение препарата обосновано хроническим заболеванием, доза соответствует терапевтическим. Лекарственный препарат «Коделак» в 1 таблетке содержит 8 мг кодеина. В соответствии официальному электронному документу МЗ РФ «Государственному реестру лекарственных средств» высшая разовая терапевтическая доза кодеина для взрослых составляет 0,05 г (50 мг) на 1 прием, а суточная – 0.2 г (200 мг ). Следует учесть, что при приеме внутрь препаратов содержащих кодеин, происходит его трансформация в организме в морфин (один из метаболитов) и конечная концентрация этих веществ, обнаруживаемая в крови и моче зависит от индивидуальных генетических особенностей организма и функции внутренних органов. Кодеин и морфин относятся к одной фармакологической группе соединений – опиатам, т.е. производным морфина.
Информация (заключение экспертов). Из материалов следствия: результаты освидетельствования на состояние наркотического опьянения пострадавшего показали наличие в его моче кодеина в концентрации 6450 нг/мл и морфина в концентрации 1848 нг/мл. Следуя логике экспертов, указанные концентрации могут быть обнаружены в моче чрез 2-3 часа после одномоментного приема 11 таблеток «Коделака» (90 мг кодеина). В рамках наркологической экспертизы, количество выпитых пациентом таблеток препарата «Коделак» эксперты определили по нижеуказанной таблице 2.3, составленной в ходе проведения эксперимента с участием всего трех здоровых испытуемых.
В таблице приведена концентрация кодеина и морфина (в нг/мл) в моче для трех человек, принявших разовую дозу кодеина 90 мг. Оба соединения в моче детектируются в течение 3 дней (72 часа).
Таблица 2.3
II. Аналитический раздел
Учебная карта темы.
1. Практическая часть:
1.1. Примеры решение ситуационных задач.
1.2. Вопросы и ситуационные задачи для закрепления материала.
1.3. Контрольные вопросы.
2. Экспериментальная часть (лабораторная работа).
3. Контроль усвоения темы (тесты текущего уровня).
Практическая часть
1.1.Ситуационные задачи (№№ с 1 по 4) с алгоритмами их решений, эталонами ответов и с комментариями.
Таблица №3.1
Таблица №3.2
Расчетные формулы
Контрольные задачи
1. В каком из растворов хлорида натрия: 2%, 0,86%, 0,2% жизнедеятельность эритроцитов не будет нарушена и почему? 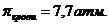 , T=37оС. Плотность растворов и степень диссоциации NaCI считать равными единице.
, T=37оС. Плотность растворов и степень диссоциации NaCI считать равными единице.
2. Изотоничны ли растворы мочевины и уксусной кислоты с массовой долей 0,6%, если степень диссоциации уксусной кислоты равна 0,01, ρ =1 г/мл?
3. Магния сульфат / 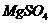 / в медицинской практике применяют как слабительное, желчегонное и успокаивающее действие на ЦНС. При концентрации препарата в крови 9-10 мг% наступает снотворный эффект, а при 15-18 мг% – наркотическое состояние. Большие концентрации могут вызвать угнетение дыхания. Определите осмотическое давление раствора сульфата магния концентрации 0,005 моль/л при 18оС, если кажущаяся степень диссоциации этой соли равна 66%.
/ в медицинской практике применяют как слабительное, желчегонное и успокаивающее действие на ЦНС. При концентрации препарата в крови 9-10 мг% наступает снотворный эффект, а при 15-18 мг% – наркотическое состояние. Большие концентрации могут вызвать угнетение дыхания. Определите осмотическое давление раствора сульфата магния концентрации 0,005 моль/л при 18оС, если кажущаяся степень диссоциации этой соли равна 66%.
4. Никотинамид (пиридин-3-карбоновой кислоты) в медицинской практике применяют как специфическое противоаллергическое средство. Осмотическое давление крови при 37оС равно 7.7 атм. Будет ли изотоничен крови 2% раствор никотинамида /  (витамин РР), ρ=1,03 г/мл?
(витамин РР), ρ=1,03 г/мл?
5. Общая осмотическая концентрация в плазме крови в норме составляет 0,3 моль/л. Вычислите осмотическое давление плазмы крови при T=25oC.
6. Осмотическое давление раствора, содержащего 0,2 г белка в 10 мл, при 25оС равно 10-3 атм. Определить молярную массу белка.
7. Рассчитайте осмотическое давление 20%-ного водного раствора глюкозы (ρ = 1,08 г/мл) при 310 К, применяемого для внутривенного введения, например, при отеке легкого. Каким будет этот раствор (гипо-, гипер-, изотоническим) по отношению к крови, если учесть, что π крови равно 740-780 кПа?
8. Чему равно осмотическое давление раствора при 20оС, в 100 мл которого содержится 6,33 г красящего вещества крови – гематина (Mr (С34Н33N4O5Fe=633 г/моль))?.
9. Что произойдет с эритроцитами крови, если их поместить в 3 моль/л раствор глюкозы? 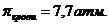 , при T=37оС.
, при T=37оС.
10. Что произойдет с эритроцитами при 310 К в 2%-ном растворе глюкозы (ρ=1,006 г/мл)
11. В каком из двух растворов глюкозы отклонение от закона Рауля будет больше: с С=0,1М или С=0,2М? Дайте пояснения.
12. В каком случае отклонение от закона Рауля будет больше: в растворе уксусной кислоты с моляльной концентрацией 0,05 моль/кг или в соляной кислоте с такой же моляльной концентрацией? Дайте пояснения.
13. Вычислите температуру кипения и температуру замерзания 4,6% раствора глицерина в воде.
14. Вычислите температуру кипения и температуру замерзания водного раствора сахарозы с массовой долей 2%.
15. Давление пара чисто  го ацетона при 20°С 23940 Па. Давление пара раствора камфоры в ацетоне, содержащего 5 г камфоры на 200 г ацетона при той же температуре, равно 23 710 Па. Определить молекулярную массу камфоры, растворенной в ацетоне.
го ацетона при 20°С 23940 Па. Давление пара раствора камфоры в ацетоне, содержащего 5 г камфоры на 200 г ацетона при той же температуре, равно 23 710 Па. Определить молекулярную массу камфоры, растворенной в ацетоне.
16. Определите эбулиоскопическую постоянную ацетона, если раствор, содержащий 4,6 г глицерина / 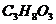 / в 200 г ацетона /
/ в 200 г ацетона / 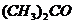 /, кипит при температуре 56,43оС. Ткип(
/, кипит при температуре 56,43оС. Ткип(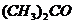 ) =56оС.
) =56оС.
17. Температура замерзания сыворотки крови равна -0,56оС. Рассчитайте моляльную концентрацию солей в крови, условно считая все соли бинарными и полностью распадающимися на ионы по схеме: 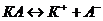 . Наличие в сыворотке неэлектролитов во внимание не принимать.
. Наличие в сыворотке неэлектролитов во внимание не принимать.  К∙кг/моль.
К∙кг/моль.
Экспериментальная часть
Лабораторная работа. Определение молярной массы неэлектролита
Криоскопическим методом
Принцип метода. В основе криоскопического метода определения молекулярной массы вещества лежит закон Рауля, причем он справедлив для сильно разбавленных растворов неэлектролитов. При затвердевании такого раствора сначала выпадают кристаллы чистого растворителя, и раствор становится более концентрированным, а температура кристаллизации – наиболее низкой. Поэтому при определении температуры затвердевания раствора следует измерять температуру начала кристаллизации. При этом нельзя допускать сильного переохлаждения раствора (более чем на 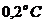 ).
).
Криоскопический метод является более точным, чем эбуллиоскопический, так как в этом случае не происходит потери растворителя путем испарения, криоскопическая постоянная воды больше эбуллиоскопической, что повышает точность отсчетов при определении ∆  . В криоскопическом методе точность определения молекулярной массы зависит от точности измерения температуры. Для этого пользуются специальным термометром Бекмана (см. рисунок 3.1(а)), предназначенным для измерения малых разностей температур.
. В криоскопическом методе точность определения молекулярной массы зависит от точности измерения температуры. Для этого пользуются специальным термометром Бекмана (см. рисунок 3.1(а)), предназначенным для измерения малых разностей температур.
Цель работы. Научиться методом криоскопии определять молярную массу растворенного вещества.
Приборы и оборудование: криометр, дифференциальный термометр Бекмена, термометр химический.
Реактивы: лед колотый или снег, хлорид натрия (крист.), навеска исследуемого вещества (сахароза С12Н22О11); вода дистиллированная.
Ход работы:
1. Заполните внешний сосуд криометра (см. рисунок 3.1), т.е. стакан / 4/ охладительной смесью из воды, льда и технической соли 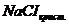 (40-50 г) с температурой на 3–4о ниже 0оС, закройте его крышкой со вставленной в нее мешалкой /5/ и сосудом / 3/.
(40-50 г) с температурой на 3–4о ниже 0оС, закройте его крышкой со вставленной в нее мешалкой /5/ и сосудом / 3/.

2. Отмерьте из бюретки в сосуд / 3/, или взвесьте на аналитических весах, ≈ 20,00 см3 растворителя / 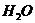 /.
/.
3. Настройте термометр Бекмана / 1 / и вставьте в прибор в вертикальном положении, он не должен касаться стенок сосуда. После настройки данный термометр нельзя класть горизонтально и встряхивать, чтобы из капилляра в верхний резервуар не упала капелька ртути.
4. Медленно помешивайте жидкость до температуры на 0,5оС выше ожидаемой температуры кристаллизации, затем, прекратив помешивание, наблюдайте за понижением температуры (для чистого растворителя до –0,5- –1,0оС).
5. Возобновите перемешивание переохлажденной жидкости, что вызовет кристаллизацию и повышение температуры. Не прекращая перемешивания, отмечайте максимальную температуру подъема (из переохлажденного состояния), которая и будет истинной температурой кристаллизации данной жидкости.
6. Выньте сосуд / 3/ из стакана / 4/ и, подогревая его рукой, растворите образовавшиеся кристаллы.
7. Опустите сосуд / 3/ снова в стакан / 4/ и повторите переохлаждение с последующей кристаллизацией. Опыт повторите несколько раз, пока последние два определения температуры кристаллизации будут отличаться не более чем на 0,01оС.
8. Определив температуру кристаллизации растворителя, через боковой тубус сосуда / 3/, всыпьте навеску исследуемого вещества и, вынув сосуд с веществом и растворителем, подогрейте его рукой, вызывая расплавление кристаллов растворителя и растворение в нем навески.
9. Вставив сосуд в стакан /4/, проведите процесс охлаждения так же, как это предписано выше в пп. 3-5. (Раствор переохлаждать более чем на 0,2 оС нельзя).
10. Все вышеуказанные данные и результаты опыта внесите в таблицу № 3.1.
11. Отчет о работе состоит из непосредственной записи наблюдений и вычислений по ниже указанной форме.
а) Температуру кристаллизации раствора определите 3–4 раза; из полученных данных рассчитайте среднюю температуру кристаллизации / 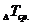 / и разность средних температур кристаллизации растворителя, раствора
/ и разность средних температур кристаллизации растворителя, раствора 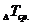 по формуле:
по формуле: 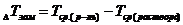 .
.
б) Рассчитайте молярную массу растворенного вещества по формуле: 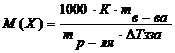 ,
,
где 
 – масса растворенного вещества, г;
– масса растворенного вещества, г; 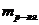 - масса растворителя (воды, г).
- масса растворителя (воды, г).
Таблица №3.1
Образец теста
1. У больного наблюдается образование отека, т.е. накопление жидкости в межтканевом пространстве и такое состояние водного баланса для последующего выбора курса лечения в медицине оценивают, как ______.
1) положительный
2) отрицательный
3) физиологичный
4) нулевой
2. Факторами возникновения осмоса в живой клетке являются _____.
1) несмешивающиеся жидкости, разделенные полупроницаемой мембраной
2) растворы с одинаковой концентрацией, разделенные полупроницаемой мембраной
3) растворы с разной молярной концентрацией, разделенные полупроницаемой мембраной
4) растворы с разными несмешивающимися растворителями
3. Нижеуказанный раствор _____ изотоничен по отношению к 0,9% раствору NaCl.
1) любого соединения, имеющего такую же концентрацию частиц, как и 0,9% NaCI
2) любого соединения, имеющий концентрацию 0,9%
3) NaCI-любой концентрации
4) NaCI с осмотическим давлением до 260-300 кПа
4. При помещении клетки в гипотонический раствор NaCl преимущественное направление диффузии наблюдается тогда, когда _____.
1) NaCI диффундирует из клетки
2) H2O диффундирует из клетки
3) NaCI диффундирует в клетку
4) H2O диффундирует в клетку
5. Плазмолиз клеток будет наблюдаться при помещении их в раствор NaCl концентрации _____.
1) 0,1% р-р
2) 10% р-р
3) 0,9% р-р
4) 0,5% р-р
6. Явление гемолиза эритроцитов будет наблюдаться при помещении их в раствор NaCI определенной концентрации _____.
1) 10 %
2) 5 %
3) 0,9 %
4) 0,1 %
7. Формула π=CRT (закон Вант-Гоффа), показывающая зависимость осмотического давления от концентрации и температуры, применима _____.
1) только к растворам неэлектролитов
2) к любым растворам
3) только к растворам электролитов
4) к растворам слабых электролитов
8. Для расчета осмотического давления растворов электролитов вводится изотонический коэффициент и тот фактор, который определяет величину данного коэффициента – это _____.
1) молекулярная масса вещества
2) природа растворителя
3) степень диссоциации растворенного вещества
4) осмотическое давление
9. Раствор с наибольшим осмотическим давлением является _____.
1) 0,1 М 
2) 0,1 М белка
3) 0,1 М 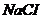
4) 0,1 М 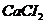
10. Гипертонические растворы солей 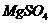 и
и  применяются в качестве слабительных средств и для расчета осмотического давления для данных солей справедливо выражение _____.
применяются в качестве слабительных средств и для расчета осмотического давления для данных солей справедливо выражение _____.
1) 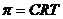
2) 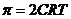
3) 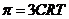
4) 
11. Если увеличить концентрацию физиологического раствора NaCI (0,9%), то температура кипения  соли в нем ______.
соли в нем ______.
1) в начале повысится, а потом понизится
2) не изменится
3) повысится или понизится в зависимости от природы растворителя
4) повысится
12. Наибольшее давление водного раствора пара будет наблюдаться над раствором, в 1 литре которого растворено ______ граммов глюкозы.
1) 90
2) 60
3) 30
4) 10
4. Вопросы по теме для самостоятельного изучения их студентами.
1. Информационно-структурная память воды. Дисбаланс ионов и воды в клетке при ее повреждении.
2. Диализ - практическое применение явления диффузии в медицинских исследованиях.
5. Практические навыки, которыми должен овладеть студент по теме занятия. Студент должен владеть навыками:
- вычисление осмотического давления и изменения температуры кристаллизации и кипения растворов для прогнозирования и интерпретации явления, которые наблюдаются с живой клеткой;
- умения работать с учебной, научной и справочной литературой, а также с сетью Интернет для постоянного усовершенствования своих знаний, с целью анализировать сложившуюся ситуацию и принимать решения в пределах своей профессиональной компетенции и полномочий.

Учебная карта темы.
1. Практическая часть:
1.1. Примеры решение ситуационных задач.
1.2. Вопросы и ситуационные задачи для закрепления материала.
1.3. Контрольные вопросы.
2. Экспериментальная часть (лабораторная работа).
3. Контроль усвоения темы (тесты текущего уровня).
Практическая часть
1.1.Ситуационные задачи (№№ с 1-по 8) с алгоритмами их решений, эталонами ответов и с комментариями
Экспериментальная часть
Лабораторная работа. Факторы, влияющие на гидролиз веществ
Цель работы. Экспериментально определить влияние различных нижеуказанных факторов на степень гидролиза солей и доказать его ступенчатый характер, а также определить природу конечного продукта гидролиза.
Оборудование: набор пробирок в штативе, спиртовки, спички, держатели для пробирок.
Реактивы: растворы – хлорида, ацетата, сульфита и карбоната натрия; сульфата алюминия; карбоната аммония; хлорида висмута; фенолфталеина; концентрированная соляная кислота; дистиллированная вода; универсальная индикаторная бумага.
Таблица 4.1
Образец теста
1. При экспериментальном определении электролитного состава ротовой жидкости установлено содержание белков 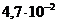 моль/л, поэтому тип данного электролита в медицине расценивают, как _____.
моль/л, поэтому тип данного электролита в медицине расценивают, как _____.
1) сильный
2) слабый
3) слабый
4) полиэлектролит
2. Степень диссоциации 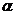 и концентрации ионов
и концентрации ионов 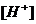 в 0,01 М растворе молочной кислоты /
в 0,01 М растворе молочной кислоты / 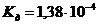 /, которая была предназначена для проведения биохимических исследований составили _____ % и _____ в моль/л соответственно.
/, которая была предназначена для проведения биохимических исследований составили _____ % и _____ в моль/л соответственно.
1) 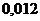 и
и 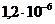
2) 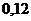 и
и 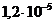
3) 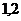 и
и 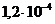
4) 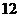 и
и 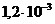
3. Активность иона цинка в растворах с массовой долей сульфата цинка 0,1%; 0.25% (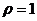 г/мл), предназначенный в качестве глазных капель как антисептическое средство составляют _____ и _____ моль/л.
г/мл), предназначенный в качестве глазных капель как антисептическое средство составляют _____ и _____ моль/л.
1) 0,006 и 0,0048
2) 0,003 и 0,0045
3) 0,05 0,045
4) 0,06 и 0,048
4. С целью моделирования физиологических процессов, которые происходят в слюне, необходимо приготовить раствор натрия хлорида 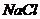 с величиной ионной силы 0,15 моль/л, учитывая при этом, что молярная концентрация данного раствора составила _____ моль/л.
с величиной ионной силы 0,15 моль/л, учитывая при этом, что молярная концентрация данного раствора составила _____ моль/л.
1) 0,015
2) 0,03
3) 0,15
4) 1,5

 Практикум по химии
Практикум по химии


 и др.
и др.


