Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ВФС - Временные фармакопейные статьи.
Утверждаются на первые промышленные серии нового лекарственного средства или новые виды лекарственного сырья — только что разрешенные к применению и серийному производству МЗ РФ. Утверждаются на ограниченный срок - не более 3 лет. После этого ВФС пересматривают и выпускают ФС. Требования ФС и ВФС обязательны для всех предприятий и организаций Российской Федерации, где производится, хранится, контролируется, реализуется и применяется лекарственное растительное сырье. ФСП - стандарт качества лекарственного средств а под торговым названием конкретного предприятия, учитывающий особенности технологии данного предприятия. Разрабатывается с учетом требований ГФ, требования должны быть не ниже ГФ XI издания. Срок действия ФСП зависит от уровня технологического процесса конкретного производства лекарственного средства, но сроком не более 5 лет. Создается ФСП организацией-разработчиком или предприятием-производителем (чаще совместно) и является объектом их авторского права. Держателем подлинников ФСП является Министерство здравоохранения РФ и соответствующее предприятие или организация-разработчик. 5. Определение понятия "растворимость", условные термины, принятые ГФ и Британской фармакопеей для выражения растворимости. Способы определения растворимости соединений с неизвестной растворимостью. В фармакопейном анализе понятие растворимости приводится в качестве характеристики приблизительной растворимости фармацевтических субстанций и вспомогательных веществ (далее – веществ) при фиксированной температуре. Испытание, если нет других указаний в фармакопейной статье, следует проводить при температуре (20 ± 2) ºC. Если растворимость является показателем чистоты вещества, то в фармакопейной статье должны быть представлены конкретные количественные соотношения вещества и растворителей. Рекомендуется использовать растворители разной полярности (обычно три); не рекомендуется использование легкокипящих и легковоспламеняющихся (например, диэтиловый эфир) или очень токсичных (например, бензол, метиленхлорид) растворителей. Растворимость вещества (в пересчете на 1 г вещества) выражают в следующих терминах, приведенных в таблице.
Вещество считают растворившимся, если в растворе при наблюдении в проходящем свете не обнаруживаются частицы вещества. В растворе могут присутствовать следовые количества физических примесей, например, таких как волокна фильтровальной бумаги. Для веществ, образующих при растворении опалесцирующие растворы, соответствующее указание должно быть приведено в фармакопейной статье. Термин «смешивается с…» используется для характеристики жидкостей, смешивающихся с указанным растворителем во всех соотношениях. Если указано, что вещество растворимо в жирных маслах, то имеется в виду, что оно растворимо в любом масле, относящемся к классу жирных масел. Методика определения растворимости К навеске растертого в тонкий порошок вещества прибавляют отмеренное количество растворителя и непрерывно встряхивают в течение 10 мин при (20 ± 2) ºC. Для медленно растворимых веществ, требующих для своего растворения более 10 мин, допускается нагревание на водяной бане до 30 ºC. Наблюдение производят после охлаждения раствора до комнатной температуры и энергичного встряхивания в течение 1 – 2 мин. Условия растворения медленно растворимых веществ указывают в фармакопейных статьях. Для веществ с неизвестной растворимостью испытание проводят по следующей методике. К 1,0 г растертого вещества прибавляют 1,0 мл растворителя и проводят растворение, как описано выше. Если вещество полностью растворилось, оно очень легко растворимо. Если вещество растворилось не полностью, то к 100 мг растертого вещества прибавляют 1,0 мл растворителя и проводят растворение, как описано выше. Если вещество полностью растворилось, оно легко растворимо. Если вещество растворилось не полностью, то добавляют 2,0 мл растворителя и продолжают растворение. Если вещество полностью растворилось, оно растворимо.
Если вещество растворилось не полностью, то добавляют 7,0 мл растворителя и продолжают растворение. Если вещество полностью растворилось, оно умеренно растворимо. Если вещество растворилось не полностью, то к 10 мг растертого вещества прибавляют 10,0 мл растворителя и проводят растворение, как описано выше. Если вещество полностью растворилось, оно мало растворимо. Если вещество растворилось не полностью, то к 10 мг растертого вещества прибавляют 100 мл растворителя и проводят растворение, как описано выше. Если вещество полностью растворилось, оно очень мало растворимо. Если вещество не растворилось, оно практически нерастворимо в данном растворителе. Для веществ с известной растворимостью испытание проводят по описанной выше методике, но только для крайних значений, относящихся к указанному термину. Например, если вещество растворимо, то 100 мг растертого вещества не должны растворяться в 1,0 мл растворителя, но должны раствориться полностью в 3,0 мл растворителя. Solubility is concerned with solute and solvent to form a homogenous mixture. If solubility of a drug is low, then usually it is difficult to achieve desired therapeutic level of drug. Most of the newly developed entities have solubility problems and encounter difficulty in dissolution. 6. Общие методы определения качества лекарственных средств по ГФ, значение этих показателей в оценке доброкачественности: температура плавления, кипения, рН раствора, летучие вещества и вода В контроле качества лекарственных средств используют физические, физико-химические, химические и биологические методы анализа. Испытания по НД включают несколько основных стадий:
Температура плавления (Т ° пл) Температура плавления является константой, характеризующей чистоту вещества и одновременно его подлинность. Из физики известно, что температура плавления – это температура, при которой твердая фаза вещества находится в равновесии с расплавом. Чистое вещество имеет четкую температуру плавления. Поскольку ЛВ могут иметь незначительное количество примесей, такой четкой картины мы уже не увидим. В этом случае определяется интервал, при котором плавится вещество. Обычно этот интервал лежит в пределах 2◦С. Более растянутый интервал свидетельствует о наличии примесей в недопустимых пределах. Согласно формулировке ГФ Х1 под температурой плавления вещества понимают интервал температуры между началом плавления (появлением первой капли жидкости) и концом плавления (полным переходом вещества в жидкое состояние). Если вещество имеет нечеткое начало или конец плавления, определяют температуру только начала или конца плавления. Иногда вещество плавится с разложением, в этом случае определяют температуру разложения, то есть температуру, при которой происходит резкое изменение вещества (например, вспенивание). Методы определения температуры плавления
Выбор метода диктуется двумя моментами:
Согласно ГФ Х1 издания, существует 4 способа определения Т ° пл:
Методы 1, 1а и 2 предполагают использование 2х приборов:
Методика общая независимо от прибора. Тонко измельченное сухое вещество помещают в капилляр средних размеров (6-8 см) и вносят в прибор при температуре на 10 градусов ниже ожидаемой. Отрегулировав скорость подъема температуры, фиксируют температурный интервал изменений вещества в капилляре При этом проводят не менее 2х определений и берут среднее арифметическое. Тпл определяют не только у чистых веществ, но и у их производных – оксимов, гидразонов, оснований и кислот, выделенных из их солей. В отличие от ГФ XI в ГФ XII изд. температура плавления в капиллярном методе означает не интервал между началом и концом плавления, а температуру конца плавления, что согласуется с Европейской фармакопеей. \ Кислотность, щёлочность, рН (ГФ XI, вып. 1, с. 113). Определённую информацию о степени чистоты лекарственных средств даёт значение рН растворов. По этому показателю можно судить о наличии примесей кислотного или основного характера. Определение осуществляется несколькими способами:
Индикаторы, как известно, являются электролитами, существующими в двух таутомерных формах. В зависимости от концентрации водородных ионов (значении рН среды) преобладает одна из этих форм, обуславливающая определённую окраску раствора. Однако, окраска индикатора указывает только на то, что рН раствора находится в пределах, где доминирует одна из форм индикатора, но не указывает истинного значения.
Например, примесь минеральных кислот в кислоте борной определяют с помощью метилового красного, который не изменяет окраски от действия слабой кислоты борной, но розовеет при наличии в ней примесей минеральных кислот. В некоторых случаях содержание примесей основного или кислотного характера оценивают количественно. Например, для установления допустимой примеси муравьиной кислоты, образующейся при хранении раствора формальдегида, проводят её алкалиметрическое определение. Данной примеси должно быть в препарате не более 0,2 %. В большинстве случаев для характеристи кислотности или основности растворов в НД на лекарственные вещества вводится раздел –
Готовят растворы определённой концентрации по ФС, в которой указан интервал значений величины рН. Например, для 5 % раствора сульфацила натрия - рН 8,5-9,5. В промышленном производстве определение рН обязательно для всех инъекционных растворов и субстанций. В аптеках ежедневно обязательно контролируют рН воды очищенной (5,0-7,0) и всех инъекционных растворов до и после стерилизации. Несоответствие значения рН требованиям НД может быть свидетельствовать о наличии примесей, более основного или кислого характера, чем само вещество. П римеси появляются при хранении ЛВ и ЛФ:
Способы определения рН растворов Для определения рН по ГФ XI, вып. 1, с. 113 применяются два метода:
рН (водородный показатель ) – это отрицательный десятичный логарифм активности ионов водорода. рН = - lg aH+ На практике чаще используют не значения активностей, а значения концентраций ионов водорода и рН находят по формуле рН = - lg [H+] Например, [Н+] = 10-2, рН = 2. Потенциометрический метод – определение рН заключается в измерении ЭДС гальванического элемента, состоящего из двух электродов: индикаторного и электрода сравнения. Разница ЭДС между этими двумя электродами (потенциал индикаторного электрода) определяется активностью ионов водорода в исследуемом растворе, а потенциал электрода сравнения (или стандартного электрода) известен. В качестве индикаторных электродов ГФ XI рекомендует применять стеклянный (чаще других) и хингидронный электроды, редко допускаются использование водородного электрода. На практике расчёты при определении рН не производятся, т.к. шкала лабораторных рН-метров градуирована в величинах рН. Для измерения рН применяют потенциометры, рН-метры, иономеры. Колориметрический метод измерения рН основан на применении индикаторов, которые изменяют свою окраску в зависимости от активности ионов водорода в определенном интервале рН (переходят в таутамерную форму).
Для определения готовят серию (шкалу) стандартных буферных растворов (5-6) с интервалом 0,2 рН или 0,1 рН. К равному объёму исследуемого и всех буферных растворов шкалы, прибавляют одинаковый объём раствора индикатора и сравнивают окраску. Значение рН равного по окраске буферного раствора соответствует рН исследуемого раствора. Точному определению предшествует приблизительное определение рН с помощью индикаторной бумаги или индикатора, обладающего широкой областью перехода. П одбирается индикатор так, чтобы предполагаемая величина рН попала в центральную часть интервала перехода окраски индикатора и серии стандартных буферных растворов. Достоинство метода:
Недостатки метода:
Определение летучих веществ и воды Летучие вещества могут попасть в ЛП либо вследствие недостаточной очистки от растворителей и промежуточных продуктов в процессе получения, либо в результате накопления продуктов разложения. Вода в лекарственных веществах может содержаться в виде капиллярной, абсорбционно-связанной, химически связанной (гидратной и кристаллогидратной) или свободной. ГФ XI, вып. 1, с. 177 «Определение воды», описывает три метода определения летучих веществ и воды.
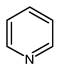
SO2 + I2 + Метод основан на свойстве йода взаимодействовать с диоксидом серы только в присутствии воды в две стадии. Продукты реакции (H2S04 и HJ) связывается пиридином, что количественно сдвигает равновесие вправо. H2O + SO2 + I2 + 3C5H5N ®2C5H5N · HI + C5H5NSO3 C5H5NSO3 + CH3OH ® C5H5N × HSO4CH3
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 927; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.131.238 (0.043 с.) |
 +CH3OH
+CH3OH