
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Коррозия металлов и защита металлов от коррозииСтр 1 из 5Следующая ⇒
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ ЛНР ГОУ ВПО «ЛУГАНСКИЙ НАЦИОНАЛЬНЫЙ УНИВЕРСИТЕТ Имени ВЛАДИМИРА ДАЛЯ»
МЕТОДИЧЕСКИЕ УКАЗАНИЯ к самостоятельной работе и проведению текущего контроля знаний студентов по дисциплине “ХИМИЯ” (РАЗДЕЛ ”ЭЛЕКТРОХИМИЯ”) (для студентов инженерных специальностей)
У Т В Е Р Ж Д Е Н О на заседании кафедры физики и химии протокол № 9 от 23.05.17
Луганск 2017
УДК 571.1 (07) Методические указания к самостоятельной работе ипроведению текущего контроля знаний студентов по дисциплине «Химия», (раздел «Электрохимия») для студентов инженерных специальностей / Сост. В.Л. Абраменко, А.А. Григорьева. – Луганск: изд-во ЛНУ им. В.Даля, 2017. – 48 с.
Методические указания предназначены для самостоятельной подготовки студентов по разделу «Электрохимия» и для выполнения контрольной работы. Они содержат теоретическое введение по теме, позволяющее студенту самостоятельно изучить электрохимические процессы: теорию гальванических элементов, химизм коррозионных явлений и основы процессов электролиза. Для контроля знаний составлено 30 вариантов однотипных заданий среднего уровня и 15 вариантов нестандартных заданий повышенной сложности.
Рецензент О.Р. Игнатов, кандидат технических наук, доцент
Составители: доцент В.Л. Абраменко доцент А.А. Григорьева
ЭЛЕКТРОХИМИЧЕСКИЕ ПРОЦЕССЫ
Электрохимия изучает обширную область физико-химических процессов, которые условно можно разделить на две группы: 1) процессы, связанные с возникновением разности потенциалов и получением электрической энергии за счет окислительно-восстановительной реакции (химические источники тока); 2) осуществление окислительно-восстановительной реакции и получение веществ за счет затраты электрической энергии (электролиз). К первой группе явлений следует отнести и электрохимическую коррозию, поскольку механизм возникновения коррозионных токов имеет ту же природу, что и механизм получения электрического тока в гальванических элементах. Эти темы наиболее глубоко и полно рассмотрены в учебниках В.В. Фролова, Н.В. Коровина, Н.Л. Глинки, В.И. Кириченко. Кроме того, по отдельным вопросам электрохимии опубликована многочисленная дополнительная литература. В курсе общей химии для нехимических специальностей указанные явления рассматриваются при изучении следующих тем: «Гальванические элементы», «Коррозия металлов и защита от коррозии», «Электролиз».
Гальванические элементы
Рекомендации к изучению теоретического материала Гальванические элементы (ГЭ) - это системы или устройства, в которых энергия окислительно-восстановительных реакций превращается в электрическую энергию. В основе работы всех ГЭ лежит явление возникновения потенциала на границе металл - электролит. Стоит внимательно изучить по учебнику особенности процесса возникновения электродного потенциала, обратив внимание на факторы, влияющие на его величину (температура, концентрация раствора электролита, материал электрода и др.). Вполне понятно, что разные по природе металлы имеют различную электролитическую упругость растворения (т.е. способность посылать свои ионы в раствор). Отсюда следует, что при одинаковых условиях величина электродных потенциалов различных металлов будет разная. Впервые зависимость величины электродного потенциала (Е) от различных факторов определена В.Нернстом (1888 г.):
Е = RT/nF · ln C / C 0,
где R- универсальная газовая постоянная; Т - абсолютная температура (К);
n - число электронов в реакции окисления металла; F - постоянная Фарадея; C и С 0 - концентрация иона металла в глубине раствора и на поверхности электрода. Концентрацию С0 невозможно определить точно; отсюда следует, что абсолютное значение электродного потенциала определить невозможно. На практике определяют разность потенциалов, то есть, потенциал данного электрода относительно другого электрода, потенциал которого принят за стандарт. Чаще всего таким стандартным электродом выступает нормальный (стандартный) водородный электрод, потенциал которого принят за 0 В. В этом случае величину электродных потенциалов (Е) можно вычислить по уравнению Нернста: Е = Е0 + или в упрощенном виде: Е = Е0 + где Е0 - стандартный электродный потенциал металла - табличные данные;
R - универсальная газовая постоянная; Т - абсолютная температура (К); n - число электронов в реакции окисления металла; F - постоянная Фарадея; а где f - коэффициент активности. Если принять, что температура, при которой определяется потенциал, равна 250С (298К), то после небольших преобразований имеем с незначительной погрешностью удобную для большинства расчетов формулу:
Е = Е0 + Здесь Е0 - стандартный электродный потенциал данного электрода относительно нормального водородного электрода при условии, что концентрация (точнее, активность а) ионов металла равна 1 моль /л. Гальванические элементы принято обозначать в виде формул. Например, формула медно-цинкового элемента Даниэля-Якоби:
анод (-) Zn │ Zn2+(С 1)││ Cu2+(С 2) │ Cu (+) катод
На аноде протекают процессы окисления (отдачи электронов), на катоде - восстановления (приcоединения электронов). При этом электроны перемещаются по внешней цепи, выполняя полезную работу. Таким образом, при работе ГЭ процессы окисления и восстановления пространственно разобщены. Электродвижущая сила (ЭДС) гальванического элемента рассчитывается как разница потенциалов катода и анода, каждому из которых соответствует конкретная полуреакция: ЭДС = Екатода – Еанода.
Теоретически любая окислительно-восстановительная реакция (ОВР) может служить источником тока, поэтому для любой ОВР можно рассчитать ЭДС по формуле: ЭДС = DЕ = Еокислителя – Евосстановителя.
Если, согласно расчетам, ЭДС > 0, то ГЭ будет работать, а окислительно-восстановительная реакция в данных условиях возможна. Между величиной ЭДС (ΔЕ) окислительно-восстановительной реакции и изобарно-изотермическим потенциалом (ΔG) существует линейная зависимость. ΔG равна максимальной работе системы: DG =Амакс.
Максимальная работа ГЭ Амакс определяется соотношением: Амакс. = - n×F×DЕ, где n - число электронов, отданных восстановителем или принятых окислителем; F - постоянная Фарадея (96500 Кл / моль). Нетрудно вывести зависимость, связывающую уменьшение изобарно-изотермического потенциала (ΔG) и ЭДС (DЕ):
DG = - n×F×DЕ.
Необходимо ознакомиться по учебнику с разновидностями ГЭ (Вольта, Даниэля-Якоби, Гренэ, Лекланше, концентрационными, воздушно-металлическими ГЭ и др.), а также с устройством и принципом действия аккумуляторов. Ниже (таблица 1) приведены формулы химических источников тока (ХИТ), которые используются чаще всего. На практике реальный электродный потенциал ΔЕ (ЭДС) всегда ниже, чем рассчитанный по теории. Падение потенциала обусловлено побочными процессами, которые происходят при работе химических источников тока: поляризацией, наличием электрического сопротивления, потерями электричества в зоне контактов:
ΔЕпракт. = ΔЕтеор. - IR - ΔЕполяр. - ΔЕконт.
Т а б л и ц а 1 Химические источники тока
Примеры решения типовых задач Задача 1. Предложите два гальванических элемента (ГЭ), в одном из которых цинк является анодом, а во втором - катодом. Напишите уравнения реакций, происходящих на электродах при работе этих элементов, рассчитайте Э.Д.С. и ΔG при стандартных условиях. Решение. Первый ГЭ: анод (-) Zn | Zn2+ || Cu2+ | Cu (+) катод. На аноде (-): Zn0 - 2e → Zn2+; на катоде (+): Cu2+ + 2e → Cu0. ЭДС (ΔE0) = Eк - Еа = 0,34 - (-0,76) = 1,10 B. ΔG = -nFΔE = -2 · 96500 · 1,10 = -212300 Дж / моль = - 212,3 кДж / моль. Второй ГЭ: анод (-) Mg | Mg2+ || Zn2+ | Zn (+) катод. На аноде (-): Mg0 - 2e → Mg2+; на катоде (+): Zn2+ + 2e → Zn0. ЭДС (ΔЕ0) = Eк - Еа = -0,76 - (-2,38) = 1,62 В. ΔG = - nFΔE = -2 · 96500 · 1,62 = -321 660 Дж / моль = -312,66 кДж / моль.
Задача 2. Составьте схему гальванического элемента, в котором электродами является железо и медь, погруженные в растворы солей с молярными концентрациями ионов Fe2+ и Cu2+, равными 1 и 0,1 моль/л соответственно. Рассчитайте его ЭДС. Решение. Схема гальванического элемента имеет вид: анод (-) Fe | Fe2+(1 М) || Cu2+(0,1 M)| Cu (+) катод Железо имеет меньший потенциал (- 0,44 В) (по сравнению с медью) и является анодом, на котором протекает процесс окисления: Fe0 – 2e ® Fe2+. Медь, электродный потенциал которой + 0,34 В, является катодом, то есть электродом, на котором протекает восстановительный процесс:
Сu2+ + 2e ® Сu0 .
Уравнение окислительно-восстановительной реакции, характеризующее работу данного гальванического элемента, имеет вид:
Fe0 + Сu2+® Fe2+ + Сu0.
ЭДС гальванического элемента определяется как разность электродных потенциалов катода и анода: ЭДС = Ек – Еа. В указанных условиях потенциал железного электрода составляет -0,44 В (концентрация соли Fe2+равна 1 моль/л). Потенциал медного электрода необходимо рассчитать по формуле Нернста (поскольку концентрация соли меди равна 0,1 моль/л):
Е
Следовательно, ЭДС ГЭ составит: ЭДС = 0,31 – (-0,44) = 0,75 В.
Задача 3. Какой гальванический элемент называется концентрационным? Составьте схему, напишите электронные уравнения электродных процессов и вычислите ЭДС гальванического элемента, состоящего из серебряных электродов, погруженных соответственно в 0,01 М и 0,1 М растворы нитрата серебра. Решение. Гальванический элемент может быть составлен не только из разных, но и из одинаковых металлических электродов, погруженных в растворы солей этого металла, различающиеся только концентрацией - концентрационные гальванические элементы. Стандартный электродный потенциал Е0Ag+/Ag = 0,80 В. Обозначим потенциал первого электрода Е1, а второго - Е2, тогда: Е1 = 0,80 + 0,059·lg0,01 = 0,68 В; Е2 = 0,80 + 0,059·lg0,1 = 0,74 В. Поскольку Е1<Е2, то первый электрод будет служить отрицательным полюсом элемента (анодом), и электроны будут перемещаться от него ко второму электроду (катоду):
(-) Ag │ AgNO3 (0,01M)││ AgNO3 (0, 1 M) │Ag (+) Анодный процесс (окисление): Ag0 – e ® Ag+ Катодный процесс (восстановление): Ag+ + е ®Ag0. Суммарно: Ag0+ Ag+= Ag++ Ag0 .
Рекомендации к изучению теоретического материала Коррозия металлов - самопроизвольный процесс разрушения металла (ΔG <0), который протекает под действием окружающей среды и проходит с выделением тепла (ΔН <0) и рассеянием вещества (ΔS> 0). Коррозию следует отличать от эрозии - механического разрушения. Возможность протекания любой химической реакции, включая коррозию, определяется изменением энергии Гиббса ΔG. Поэтому становится понятным, почему возможна коррозия магния и даже меди в агрессивной среде, в то время как золото коррозии не поддается: Mg + H2O(ж) + ½ O2® Mg(OH)2; DG = -591,6 кДж; Сu + H2O + ½ O2® Сu(OH)2; DG = -119,5кДж; Au + 3/2H2O + ¾ O2® Au(OH)3 ; DG = +65,6 кДж. Коррозию классифицируют:
1. По геометрическому характеру коррозионных разрушений: сплошная (равномерная); межкристаллитная; неравномерная; питтинг; транскристаллитная; структурно-избирательная; пятнами; подповерхностная.
2. По механизму протекания коррозионных процессов: а) химическая: б) электрохимическая: в) особые виды: - газовая - контактная - биологическая - жидкостная - концентрационная - радиационная - электрокоррозия - ультразвуковая -кавитационная и др. Следует четко различать механизм протекания химической и электрохимической коррозии. Химическая коррозия – это окислительно-восстановительный процесс разрушения металлов под действием окружающей среды, не сопровождающийся возникновением электрических коррозионных токов. Газовая коррозия - наиболее распространенный вид химической коррозии, что обусловлено взаимодействием металлов с О2, SO2, H2S, CO, CO2 и другими газами. Химизм коррозии под воздействием кислорода выражается уравнением:
nMe + m/2O2 → MenOm, то есть, по механизму протекания коррозионных процессов - это обычная гетерогенная окислительно-восстановительная реакция.
Скорость окисления металла и защитные свойства оксидных пленок зависят от целостности оксидной пленки и скорости диффузии окислителя через пленку. Целостность пленки и ее защитные свойства определяется фактором
Пиллина-Бэдвордса (α), который определяется как a = VMexOy - объём полученного после окисления оксида данного металла. Если a> 1, то такая пленка обладает защитными свойствами (подробно об этом читайте в учебнике В.В.Фролова). Например, для Mg α = 0,79. Следовательно, такая оксидная пленка не защищает магний от коррозии. Наоборот, для Al, Ni, Ti, Cr фактор Пиллинга - Бэдвордса равен 1,31, 1,52, 1,76 и 2,02 соответственно. Такие пленки обладают защитными свойствами. На поверхности некоторых металлов (Cr, Ni) образуются тонкие (до 40 мкм), незаметные глазу, но плотные оксидные пленки. Жидкостная коррозия - это коррозия в среде жидкостей - неэлектролитов (бензин, керосин, толуол и др.). Наибольший ущерб технике и промышленности наносит электрохимическая коррозия. Механизм контактной (гальванической) коррозии связан с возникновением микро - или макрогальванопар: (-) анод Me1 │D│Me2 (+) катод где D - деполяризатор (среда) (cмотрите тему "Гальванические элементы"). При этом анодный процесс – это процесс окисления (разрушения) более активного металла, а катодный - процесс восстановления, причем деполяризатором-окислителем выступают ионы Н+ (в кислой среде: 2Н+ + 2е → Н2) или молекулы О2 (в нейтральной или щелочной среде: О2 + 2Н2О + 4е → 4ОН-). Следует помнить, что технические металлы содержат примеси других металлов и неметаллов, что приводит к появлению микрогальванопар. Необходимо обратить внимание, что электродные потенциалы металлов Е зависят от состава электролита и рН среды. Это необходимо учитывать на практике для правильного прогнозирования возможных коррозионных разрушений. Значения электродных потенциалов (В) некоторых металлов в различных средах приведены в таблице2. Т а б л и ц а 2 Значение Е металлов в различных средах, выраженное в вольтах
Согласно данным таблицы 2, электрохимический ряд напряжений нельзя считать абсолютной характеристикой свойств металлов. Так, в морской воде магний имеет потенциал -1,48 В (а не -2,38 В), цинк -0,80 (а не -0,76 В), титан -0,15 В (а не -1,63 В). Концентрационная коррозия определяется градиентом концентрации деполяризатора, например, кислорода О2 (поверхностные слои воды содержат больше кислорода, чем внутренние), вследствие чего на поверхности металла образуются анодные и катодные участки: Е = Е0 + (-) А Fe│ O2, H2O │ Fe K (+) Электрокоррозия - процесс, протекающий под влиянием постоянного электрического тока от внешнего источника (например, под воздействием блуждающих токов: ответвления тока от рельсов электрифицированного транспорта и др.). Необходимо по учебникам ознакомиться с основными способами защиты металлов от коррозии, к числу которых относятся: - создание рациональных конструкций; - обработкa окружающей данную конструкцию среды (десульфуризация бензина, керосина, мазута, масел); герметизация приборов; применение ингибиторов коррозии; - создание изолирующих пленок на металлах: низкотемпературных (смазки, лаки, краски) или высокотемпературных (хромирование, никелирование, цинкование, лужение); - химическая обработка поверхности: оксидирование, азотирование, фосфатирование, цементация; - защита металлов внешним потенциалом: протекторная, электрозащита; - создание и применение новых сплавов, новых материалов. Примеры решения типовых задач Задача 1. Одна железная деталь покрыта алюминием, а другая - медью. Какое покрытие будет анодным, а какое катодным? Составьте схемы катодного и анодного процессов, которые будут протекать во влажной среде, если покрытие в обоих случаях нарушено. Какие продукты коррозии образуются в этих случаях? Решение. Нарушение металлического покрытия при наличии электролита приводит к возникновению гальванопары, в которой покрытие может выполнять роль анода (анодные покрытия) или роль катода (катодные покрытия). Поскольку электродный потенциал железа меньше, чем у меди и больше, чем у алюминия, то покрытие алюминием является анодным, а медью - катодным. При нарушении покрытия возникнут такие гальванопары:
a) (-) Al│O2, H2O │ Fe (+)
На аноде(-): Al – 3e ® Al3+ Е0 = - 1,66 В. На катоде(+): 2H2O + O2 + 4e ® 4OH- E0 = 0,40 В. Корродирует покрытие – алюминий: 4 Al + 6H2O + 3O2 = 4Al(OH)3.
б) (-) Fe│O2, H2O │ Cu (+); На аноде(-): Fe – 2e ®Fe2+ Е0 = - 0,44 В На катоде(+): 2H2O + O2 + 4e ® 4OH- E0 = 0,40 В Корродирует железо Дальнейшее окисление идет согласно уравнению реакции: 2Fe(OH)2+ H2O + 1/2O2® 2Fe(OH)3, и далее: Fe(OH)3® FeOOH + H2O.
Задача 2. Железные цистерны применяют для транспортировки концентрированной серной кислоты. Если из цистерны вылить кислоту и оставить цистерну на воздухе открытой, то она сравнительно быстро ржавеет. Почему? Составьте электронные уравнения для такого типа коррозии. Решение. Известно, что пассивными участками (микрокатодами) в углеродистой стали является зерна карбида железа Fe3C. Зерна железа - микроаноды. В данном случае создается гальванопара "металл - соединение металла". Коррозия в кислой среде (в концентрированной серной кислоте железо пассивируется за счет образования защитной оксидной пленки) будет происходить с водородной деполяризацией: (-) Fe │H2SO4 │ Fe3C(+);
На аноде(-): Fe0– 2e ® Fe2+ На катоде(+): 2H+ + 2e ®H2 Суммарно: Fe0 + 2H+ = Fe2+ + H2
Рекомендации к изучению теоретического материала При изучении данной темы и выполнении задач по ней необходимо обратить внимание на следующее: Электролизом называется совокупность процессов, протекающих на электродах при прохождении постоянного электрического тока через расплав или раствор электролита. Как и в гальваническом элементе, электрод, на котором при электролизе происходит восстановление, называется катодом, а электрод, на котором осуществляется процесс окисления, - анодом. Для осуществления процесса электролиза собирают установку, состоящую из источника постоянного тока, электродов, емкости (электролизера), содержащий раствор или расплав электролита. Электролиз протекает не при любой разности потенциалов, а при вполне определенной, которая называется потенциалом разложения (ΔЕразл). Последний численно равен ЭДС гальванического элемента, построенного на продуктах электролиза. Можно также рассчитать потенциал разложения по формуле: ΔЕразл = Величина ΔЕразл отрицательная; это указывает на то, процесс электролиза не может протекать самопроизвольно, а осуществляется под действием тока. Поэтому величину ΔЕразл учитывают в расчётах по модулю. При электролизе расплава на аноде («+») происходит окисление аниона, а на катоде («-») - восстановление катиона. При электролизе растворов молекулы растворителя (в частности, молекулы воды) могут участвовать в процессах окисления-восстановления в соответствии со схемами:
Анод: а) рН б) рН > 7 4ОН- - 4е ® 2Н2О + О2 (Е0 = 0,40 В) Катод: а) рН < 7 2Н+ + 2е ® Н2 (Е0 = 0 В) б) рН
Поэтому следует руководствоваться следующим правилом: на катоде в первую очередь протекает тот процесс, потенциал которого больше (то есть, смещен в более положительную область); на аноде в первую очередь протекает тот процесс, потенциал которого меньше. С учетом приведенных правил можно выделить три группы металлов в ряду напряжений: I - от Li до Mn - ионы этих металлов в водных растворах не восстанавливаются (вместо них восстанавливаются молекулы воды или ионы водорода); II - от Zn до Sn - ионы металлов восстанавливаются одновременно с молекулами воды; III - металлы, расположенные после водорода - ионы этих металлов легко восстанавливаются на катоде, молекулы воды практически не восстанавливаются. Следует учитывать также возможность окисления материала анода (активный анод), а также процессы поляризации электродов, перенапряжения и т. п., которые могут изменить направление протекания процесса электролиза (более подробно с этим необходимо познакомиться по учебнику Фролова: глава «Реальные электрохимические процессы»). Например, при электролизе водных растворов хлоридов (NaCl, CuCl2, SnCl2 и др.) на инертном аноде возможно протекание следующих процессов:
а) 2Cl- - 2ē → Cl2↑ (E0 Cl2/2Cl- = 1,36 B);
б) 2H2O - 4ē → O2↑ + 4H+ (E0О2+4H+/2H2O=1,23B).
Теоретически должен происходить процесс (б), его потенциал разложения меньше. На практике, в результате перенапряжения выделения О2 на величину от 0,5 до 1 В, потенциал разложения Н2О повышается, а потенциал окисления иона Cl- остается неизменным. Поэтому, в реальных условиях происходит процесс (а), выделяется хлор. Следует иметь в виду, что реальный потенциал разложения (ΔЕпракт) всегда выше теоретического (ΔЕтеор): ΔЕпракт = ΔЕтеор + IR + ΔEполяр + ΔЕконт,
где ΔЕполяр - разность потенциалов вследствие протекания поляризационных процессов; ΔЕконт - падение потенциалов на контактах (контактная разность потенциалов). Наличие побочных процессов приводит к потерям электричества. Ниже (таблица 3) приведены значения потенциалов перенапряжения выделения Н2 и О2 (ΔUH2 и ΔUO2) на электродах, изготовленных из различных металлов. Т а б л и ц а 3 Потенциалы перенапряжения выделения водорода ΔUH2, и кислорода ΔUO2 на электродах из различных материалов
Количественные расчеты процессов электролиза можно проводить с помощью законов Фарадея: 1 .Массы или объемы веществ, выделившихся на электродах, прямо пропорциональны количеству электричества, прошедшего через электролит, и химическому эквиваленту вещества: m= k × Q= k × I × где m - масса вещества, выделяющегося при электролизе; k - электрохимический эквивалент, численно равный массе вещества (г), выделившегося при прохождении одного кулона электричества; Q - количество электричества, прошедшее через электролит, Кл; I - сила тока, А; τ - время, с; Так как k = М э / F, то: m = (М э · I · τ) / F ; для газов: V = (V э · I · τ) / F. Мэ - масса моля эквивалентов вещества, г/ моль-экв; V - объем газообразного вещества, образовавшегося при электролизе; Vэ – объем моля эквивалентов данного газа, л/ моль-экв; F - число Фарадея (96500 Кл/моль (А·с /моль), если время выражено в секундах или 26,8 А·час/моль, если время выражено в часах); 2. При прохождении через различные электролиты равного количества электричества на электродах выделяются массы веществ, пропорциональные их химическим эквивалентам: Если Q = const, то: m 1 / m 2 = М э (1) / М э (2) На практике в результате протекания побочных процессов, происходящих на электродах, образуется меньше вещества, чем это отвечает расчетным формулам. Для характеристики истинного количества вещества, выделяющегося на электродах, используют величину η (греч. «эта»), называемую выходом по току: Примеры решения типовых задач Задача 1. Электрический ток силой 6А пропускали через водный раствор нитрата натрия в течение 1,5 часа. Написать уравнения процессов, происходящих при электролизе с инертным анодом. Какие вещества и в каком количестве выделяются на электродах? Решение. В водном растворе нитрат натрия диссоциирует по схеме:
NaNO3 «Na+ + NO3- К (-) А (+)
Na+, H2O NO3-, H2O
Стандартный электродный потенциал системы Na+ + e → Na0 равен -2,71В. Стандартный электродный потенциал восстановления воды -0,41 В. Поэтому на катоде будет происходить электрохимическое восстановление воды сопровождается выделением водорода: 2Н2О + 2е → Н2 + 2ОН-, а ионы Na+ и ОН- будут накапливаться в катодном пространстве. На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода: 2Н2О - 4е → О2 + 4Н+, а ионы NO3-, Н+ будут накапливаться в анодном пространстве. Таким образом, одновременно с выделением водорода и кислорода при электролизе водного раствора нитрата натрия образуется натрий гидроксид (в катодном пространстве) и азотная кислота (в анодном пространстве), если между катодом и анодом расположена диафрагма. Суммарное уравнение: 4NaNO3 + 6Н2О → 2Н2 + О2 + 4NaOH + 4HNO3 Вычисляем количество кислорода и водорода по первому закону Фарадея: V= V Задача 2. При электролизе раствора сульфата меди на аноде выделилось 168 см3 кислорода при н.у. Сколько граммов меди выделилось на катоде? Решение. Используя закон эквивалентов, запишем: Масса меди: m Cu = Задача 3. Электрический ток силой 2,5 А, проходя через раствор электролита, за 30 минут выделяет из раствора 2,77 г двухвалентного металла. Определите, какой это металл. Решение. Используя закон Фарадея (m Мэ = Молярная масса эквивалента элемента связана с его атомной массой соотношением: Мэ = А/в (в - валентность металла), из которого следует: А = Мэ·в = 59,4·2 = 118,5 г / моль. Данный металл - олово (Sn). Билет 1 1. Гальванический элемент составлен из магниевой и медной пластин, погруженных в раствор своей соли с концентрациями:[Mg2+]=0.01M; [Cu2+]=1M.Составьте схему этого гальванического элемента. Напишите уравнения электродных процессов и суммарное уравнение реакции. Вычислите ЭДС и ∆G°298 реакции: а) в стандартных условиях; б) в указанных условиях. Сделайте вывод. 2.Два металла, Al и Zn, соединённые между собой, находятся в разных средах: а) в кислой (рН < 7), б) в нейтральной или слабощелочной (рН > 7). Составьте химические уравнения, характеризующие электрохимическую коррозию предложенной пары металлов в этихсредах. Рассчитайте ЭДС и ∆G°298 реакции для стандартных условий. 3.При электролизе водного раствора сульфата двухвалентного металла на катоде выделилось 9,1г металла, а на аноде – 1,568 л кислорода (н.у.). Определите молярную массу и название металла. Составьте полную схему электролиза раствора этой соли с инертными электродами. Укажите правильный ответ к 3-ей задаче: 1) Си, 2) Zn, 3)Ni, 4) Ga. Билет 2 1. Гальванический элемент составлен из никелевого и серебряного электродов, погруженных в раствор своей соли с концентрациями: Ni2+]=10-4M; [Ag+]=10-3M. Составьте схему этого гальванического элемента. Напишите уравнения электродных процессов и суммарное уравнение реакции. Вычислите ЭДС и ∆G°298 реакции: а) в стандартных условиях; б) в указанных условиях. Сделайте вывод. 2.Два металла, Ni и Cu, соединённые между собой, находятся в разных средах: а) в кислой (рН< 7), б) в нейтральной или слабощелочной (рН > 7). Составьте химические уравнения, характеризующие электрохимическую коррозию предложенной пары металлов в этих средах. Рассчитайте ЭДС и ∆G°298 реакции для стандартных условий. 3.Какие газы и в каких объемах (н.у.) выделяется при пропускании тока силой в 3А в течение одного часа через водный раствор серной кислоты? Составьте полную схему электролиза этого раствора с инертными электродами. Укажите правильный ответ к 3-ей задаче: 1)H2, 2) Не, 3) О2, 4)1,26л; 5)0,63л. 6) 0,315л. Билет 3 1. Гальванический элемент составлен из железной и оловянной пластин, погруженных в раствор своей соли с концентрациями: [Fe2+]=0.001M; [Sn2+]=0.1M. Составьте схему этого гальванического элемента. Напишите уравнения электродных процессов и суммарное уравнение реакции. Вычислите ЭДС и ∆G°298 реакции: а) в стандартных условиях; б) в указанных условиях. Сделайте вывод. 2. Два металла, Zn и Pb, соединённые между собой, находятся в разных средах: а) в кислой (рН< 7), б) в нейтральной или слабощелочной (рН > 7). Составьте химические уравнения, характеризующие электрохимическую коррозию предложенной пары металлов в этих средах. Рассчитайте ЭДС и ∆G°298 реакции для стандартных условий. 3. Составьте полную схему электролиза водного раствора сульфата кадмия CdSO4 с инертными электродами. Какие вещества и в каком количестве образуются у электродов при прохождении через раствор тока в 4А в течение 40мин? Укажите правильный ответ к 3-ей задаче: О2, 2) Сd, 3) Zn, 4) 11,18; 5) 5,59; 6) 0,557; 7)11,14; 8) 22,28л.
Билет 4 1. Гальванический элемент составлен из цинковой и серебряной пластин, погруженных в раствор своей соли с концентрациями:[Zn2+]=0.01M; [Ag+]=0.1M. Составьте схему этого гальванического элемента. Напишите уравнения электродных процессов и суммарное уравнение реакции. Вычислите ЭДС и ∆G°298реакции:а) в стандартных условиях; б) в указанных условиях. Сделайте вывод. 2. Два металла, Al и Cu, соединённые между собой, находятся в разных средах: а) в кислой (рН< 7), б) в нейтральной или слабощелочной (рН > 7). Составьте химические уравнения, характеризующие электрохимическую коррозию предложенной пары металлов в этих средах. Рассчитайте ЭДСи ∆G°298 реакции для стандартных условий. 3. Составьте полную схему электролиза водного раствора сульфата цинка ZnSO4 с графитовыми электродами. Вычислите силу тока, если при электролизе раствора этой соли в течение 5 часов на аноде выделилось 6 л газа (н.у.). Какой это газ? Укажите правильный ответ к 3-ей задаче:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 306; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.89.85 (0.224 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
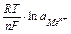
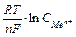 ,
,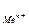 - активность металла, вычисляемая по формуле: а
- активность металла, вычисляемая по формуле: а 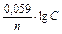 .
. Элемент Лекланше
Элемент Гренэ
“Пуговичного типа”
Воздушно-еталлический
Литиевый
Марганцево-магниевый
Медно-цинковый
Свинцово-цинковый
Свинцово-кадмиевый
Аккумуляторы:
Кислотный
Щелочной (Cd/Ni)
Щелочной(Fe/Ni)
Элемент Лекланше
Элемент Гренэ
“Пуговичного типа”
Воздушно-еталлический
Литиевый
Марганцево-магниевый
Медно-цинковый
Свинцово-цинковый
Свинцово-кадмиевый
Аккумуляторы:
Кислотный
Щелочной (Cd/Ni)
Щелочной(Fe/Ni)
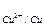 = 0,34 +
= 0,34 +  = 0,31 В.
= 0,31 В.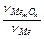 , где VMe - объём исходного количества металла,
, где VMe - объём исходного количества металла,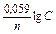 . Коррозии подвергается анодный участок:
. Коррозии подвергается анодный участок: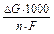
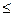 7 2Н2О –4е ® О2 + 4Н+ (Е0 = 1,23 В)
7 2Н2О –4е ® О2 + 4Н+ (Е0 = 1,23 В)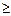 7 2Н2О + 2е ® Н2 + 2ОН- (Е0 = -0,83 В).
7 2Н2О + 2е ® Н2 + 2ОН- (Е0 = -0,83 В).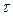 .
.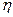 =
= 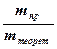 ×100%.
×100%.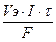 . Поскольку при нормальных условиях молярный объем эквивалента водорода равен 11,2 л/ моль-экв, кислорода – 5,6 л/ моль-экв, а
. Поскольку при нормальных условиях молярный объем эквивалента водорода равен 11,2 л/ моль-экв, кислорода – 5,6 л/ моль-экв, а 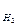 =
= 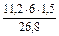 = 3,76 л; V
= 3,76 л; V 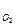 =
= 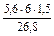 = 1,88 л.
= 1,88 л.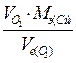 =
= 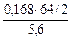 = 0,96 г. (Объем кислорода выражаем в системе СИ: 168 см3 = 168 мл = 0,168 л).
= 0,96 г. (Объем кислорода выражаем в системе СИ: 168 см3 = 168 мл = 0,168 л).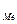 =
= 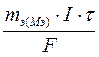 ), рассчитаем молярную массу эквивалента этого металла по формуле: Мэ =
), рассчитаем молярную массу эквивалента этого металла по формуле: Мэ = 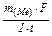 ;
;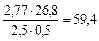 г/моль-экв.
г/моль-экв.


