Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема структура биотехнологического производства. Государственная регламентация производства лп биотехнологическими методами. Аппаратура (ферментёры и биореакторы).Стр 1 из 8Следующая ⇒
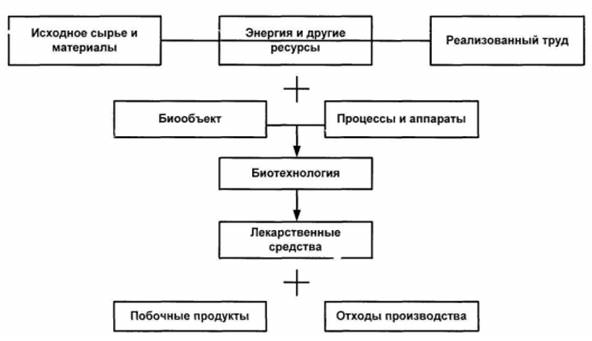
Тема Структура биотехнологического производства. Государственная регламентация производства ЛП биотехнологическими методами. Аппаратура (ферментёры и биореакторы). Задача 1. Биотехнология как наука и производство основана на использовании определенных агентов и процессов для воздействия на живую природу с целью получения ценных продуктов, в том числе и ЛС. В части анализа роли биотехнологии для современной фармации: · сравните, что отличает современную биотехнологию в ее историческом развитии; приведите схему биотехнологического производства; · расшифруйте, что понимают под терминами «агенты» и «процессы» в биотехнологии; · представьте на конкретных примерах возможности воздействия на живую природу для получения ЛС. Современные биотехнологии сыграют большую роль в качественном улучшении жизни человека, развитию экономического роста стран. Посредством биотехнологий получают новые средства для диагностики, вакцины, продукты питания, лекарства. Биотехнология помогает в увеличении урожайности всех злаковых культур, что более чем актуально, принимая во внимание рост численности населения нашей планеты. В некоторых странах, где значительные объемы биомассы не используются полностью, биотехнология в обозримом будущем превратит их в ценные продукты или в биологические виды топлива. Биотехнология все больше перестает быть прикладной наукой, она активно входит в обычную жизнь людей, помогая решать насущные проблемы современного человечества. В историческом аспекте биотехнология прошла три этапа: эмпирический, научный (родоначальник - Л. Пастер), современный. Под термином «агенты» понимают биообъекты как продуценты (источник ЛС) и ферменты (биокатализаторы). Процессы означают продуцирование (биосинтез) либо биотрансформацию (биокатализ). В качестве примера биообъектов-продуцентов можно привести грибы (эукариоты), актиномицеты и бактерии (прокариоты). Схема биотехнологического производства включает:
Задача 2. Биотехнологическое производство в фармацевтической промышленности - это система устройств периодического или непрерывного действия. С позиции системного подхода можно реально оценить соответствие конкретного устройства целям и задачам этого производства во взаимосвязи всех слагаемых процесса.
Задача 3. Биосинтез ЛС или БАВ в условиях производства требует создания стерильных условий при многостадийнности всего процесса в целом. При этом для успешного осуществления биосинтеза необходимо не допустить контаминации целевого продукта. Задача 4. Правила GMP - руководящий нормативный документ международного значения, который должны обязательно принимать к сведению как отдельные фирмы, так и все производство фармацевтических препаратов в целом. Это правила организации и контроля производства, которые составляют единую систему требований к качеству выпускаемой продукции. Все производства, интегрированные в международный рынок ЛС и медицинских препаратов, выпускающие готовые лекарственные формы и любую продукцию медицинского назначения, включая субстанции, обязаны работать по этим правилам. В то же время каждая страна, производящая ЛС, имеет свою Государственную фармакопею как руководящий документ проверки качества той или иной медицинской продукции. Проведите сравнительный анализ: · правил GMP и государственных фармакопеи с позиций требований для экспорта фармацевтической продукции; · необходимости проведения валидации как любого фармацевтического производства, так и биотехнологической продукции в частности; · правил международного значения для получения достоверных данных о проведенных испытаниях и безопасности ЛС. GMP – (GoodManufacturingPractice) – хорошая производственная практика – правила организации производства и контроля качества лекарственных средств, это единая система требований к производству и контролю. Правила GMP – это руководящий, нормативный документ, которому и производство и фирма обязаны подчиняться. Правила GMP обязательны для всех предприятий, выпускающих готовые лекарственные формы (ГЛФ), продукцию медицинского назначения, а также субстанции. Самые жесткие требования предъявляются к инъекционным лекарственным препаратам. В 1969 году около 100 государств в мире заключили многостороннее соглашения между собой. «Система удостоверения качества 66 фармацевтических препаратов в международной торговле». Система была введена под эгидой Всемирной Организации Здравоохранения (ВОЗ). Эта система была введена для оказания помощи органам здравоохранения импортирующих стран в оценке технического уровня производства и качества закупаемых ими лекарственных препаратов. В последующие годы эта система многократно пересматривалась. Система дает выгоды импортерам. Эта система дает преимущества и экспортерам (высокоразвитые страны), когда препараты идут на экспорт без лишних препятствий.
К экспортерам лекарственных средств предъявляются следующие требования: 1. В стране должна быть государственная регистрация лекарственных средств. 2. В стране должно быть государственное инспектирование фармацевтических предприятий. 3. В стране должны быть приняты правила GMP. Подобно Фармакопеям правила GMP неоднородны. Имеются: • Международные правила GMP, принимает и разрабатывает Всемирная Организация Здравоохранения (ВОЗ), • Региональные – страны европейского экономического сообщества (ЕЭС), • Правила GMP ассоциации стран Юго-Восточной Азии, • Национальные правила GMP приняты в 30 странах мира. Международные правила GMP по строгости требований усреднены, в ряде стран правила более либеральные (в соответствии с техническим уровнем производства). В Японии национальные правила GMP строже международных. Валидация – это оценка и документальное подтверждение соответствия производственного процесса и качества продукции установленным требованиям. Директор предприятия специальным приказом назначает руководящего сотрудника или специалиста со стороны для проверки качества работы какоголибо цеха, технологической линии и т.д. Валидация может быть - периодическая,(проводится постоянно) - внеплановая (при чрезвычайных происшествиях, при изменении технологии). Валидация позволяет установить: – соответствует ли технологический процесс регламенту - соответствует ли качество готовой продукции требованиям нормативной технологической документации - соответствует ли оборудование производственным целям - каков предел возможности производственного процесса Валидация оценивает: - сам процесс - предел возможных отклонений При этом составляется отчет, если имеются какие либо не соответствия или нарушения – то производственный процесс прерывается. На биотехнологическом производстве внеплановая валидация проводится если: - производство меняет штамм продуцента - изменена питательная среда (так как изменяется метаболизм продуцента и он может давать примеси). GLP – правила организации лабораторных исследований Новое лекарственное средство необходимо подвергнуть лабораторным испытаниям, прежде чем приступать к проведению клинических испытаний. Лабораторные испытания (invitro, invivo) проводятся на клетках, бесклеточных системах и животных. При испытании на животных можно получить различные результаты, поэтому важна правильная организация исследований. Животные должны быть гетерогенны (разные), корм должен быть постоянным, одинаковым; требуется определенная планировка вивария, чтобы исключить стресс у животных; животные должны быть жизнеспособны.
GCP – правила организации клинических испытаний Лекарственное средство допускается к клиническим испытаниям только после проведения лабораторных испытаний. В правилах GCP изложены права больных и добровольцев: - испытуемые должны быть информированы о том, что им вводится новый лекарственный препарат и о его свойствах - больные имеют право на финансовое вознаграждение - должен быть контроль за ходом испытаний со стороны медиков. В Европе, Соединенных Штатах Америки (США) и России введены общественные комитеты по контролю за клиническими испытаниями лекарственных препаратов. В эти комитеты входят священники, представители милиции и прокуратуры, медицинской общественности, которые наблюдают за испытаниями лекарственных препаратов. Цель клинических испытаний - получение достоверных результатов: лекарство лечит, оно безвредно и т.д. Задача 5. Очевидно, что биосинтез ЛС необходимо проводить в асептических условиях. Тем не менее проблема стерильности инъекционных препаратов и обсемененности препаратов для наружного применения остается одной из самых сложных при производстве ЛС. В этом случае можно обратиться к радиационной стерилизации ЛС. Предложите выбор радиационной стерилизации фармацевтических препаратов на конкретных примерах, используя ваши представления: · о видах и дозах облучения, режиме стерилизации, установках; · о лекарственных формах, разрешенных для этого вида стерилизации; · причинах влияния облучения на внешний вид порошка и стеклянную тару. В настоящее время в мире все более широкое распространение получает радиационный метод стерилизации перевязочного материала, хирургического инструментария, фармацевтических препаратов, сывороток, пищевых продуктов и пр. Стерилизация гамма-излучением предполагает воздействие источника ионизирующего излучения на основе радионуклида Кобальт-60 (реже – Цезий-137). Преимуществами радиационного метода стерилизации являются:
Стерилизующая доза (минимальная поглощенная доза, необходимая для достижения установленного уровня стерильности) должна составлять 25 кГр. Стерилизация имеет большое значение при изготовлении всех лекарственных форм и особенно инъекционных, так как вводятся непосредственно в кровяное русло, минуя барьеры желудочно-кишечного тракта и печени, и поэтому опасность инфицирования организма резко возрастает. В данном случае следует стерилизовать посуду, вспомогательный материал, растворитель и готовый раствор. Таким образом, работа по изготовлению растворов для инъекций должна начинаться со стерилизации и стерилизацией заканчиваться. Сложность процесса стерилизации заключается, с одной стороны, в высокой жизнестойкости и большом разнообразии микроорганизмов, с другой стороны - термолабильностью многих лекарственных веществ и лекарственных форм или невозможностью по ряду причин использовать другие методы стерилизации. Отсюда, исходят требования к методам стерилизации: сохранить свойства лекарственных форм и освободить их от микроорганизмов. Некоторые действующие вещества и лекарственные препараты, которые не могут быть подвергнуты финишной стерилизации ни одним из описанных выше методов, могут быть простерилизованы с использованием мембранных фильтров. Такие продукты требуют соблюдения специальных мер предосторожности. Производственный процесс и производственная среда должны обеспечивать минимальный риск микробного загрязнения и требуют регулярного мониторинга. Оборудование, упаковка, укупорочные средства и, по возможности, ингредиенты следует подвергать соответствующей стерилизации. Рекомендуется проводить фильтрацию непосредственно перед наполнением упаковки. Операции, следующие за фильтрацией, проводят в асептических условиях.
Задача 6. Биотехнологическое производство в фармацевтической промышленности - это система устройств периодического или непрерывного действия. С позиции системного подхода можно реально оценить соответствие конкретного устройства целям и задачам конкретного производства во взаимосвязи всех слагаемых процесса. В свете представленных задач производственного процесса при анализе ситуации используйте особенности: · конструкции ферментера («обвязка ферментера»); · систем регуляции процесса, устройств теплосистем и массообмена; · устройств систем аэрации. Биосинтез в ферментере может осуществляться только тогда, когда в ферментере имеется продуцент и он освобожден от посторонних микроорганизмов. Ферментер – это аппарат для проведения ферментации и в тоже время это техногенная экологическая ниша. Существует такое название как «обвязка ферментера», представляющая все основные рабочие узлы этого аппарата: - мешалка, для равномерного распределения всех продуктов среды, - тепловая рубашка для обогрева, - отбойники, препятствующие образованию «мертвых зон», то есть недоступных зон для регулирования ферментационного процесса, -слив для культуральной жидкости для последующего выделения целевого продукта, - барботер с воздухом для аэрации процесса ферментации, - клапаны для входа и выхода воздуха, - входное отверстие для загрузки ферментера.
Важность аэрации на стадии ферментации обусловлена тем, что большинство используемых микроорганизмов-продуцентов являются аэробами. В целом потребность в кислороде зависит от концентрации биомассы и ее метаболической активности, что требует регулирования скорости подачи воздуха в аппарат. Регуляцию осуществляют по совокупности параметров, характеризующих метаболическую активность культуры: скорости потребления углерода, азота, кислорода, интенсивности дыхания, изменения рН, концентрации растворенного кислорода, вязкости культуральной жидкости, концентрации биомассы и т.д. Кроме того, добавление компонентов питательной среды ведет к значительному разбавлению культуральной жидкости и увеличению ее объема в ферментере, что позволяет делать периодические отборы культуральной жидкости, которая затем передается в цех очистки Задача 7. Существуют вполне определенные требования и условия для создания и развития биотехнологического производства ЛС. В частности, это касается проблемы выбора биообъектов для масштабирования производства. Имеются существенные различия между диким штаммом и промышленным штаммом. Штамм обладает вполне конкретными свойствами природного характера, а производственный процесс имеет свои требования к этому штамму. Существуют способы воздействия на дикий штамм с целью удовлетворения требований производства ЛС. Задача 8. Как известно, при использовании клеточной инженерии при создании новых продуцентов широко применяют методику прото-пластирования (получения протопластов) как процесс конструкции гибридных структур. В плане решения задачи получения новых продуцентов как источников новых ЛС предложите: · схему получения протопластов и гибридных структур; · условия сохранения протопластов; · конечные цели, достигаемые с помощью продуктов гибридной природы. Для получения гибридных клеток применяют технику протопластирования, которая включает следующие этапы: выбор биообъектов (прокариот, эукариот); - обработку клеточных стенок ферментами; - стабилизацию протопластов (10% гипертонический раствор аннита, сахарозы, хлорида натрия);- слияние протопластов в среде ПЭГ; для облегчения фузии клетки обрабатывают солями металлов,- ферментами или быстро меняют температуру, т.е. делают их компетентными; при слиянии (фузии) получается протопласт с двумя наборами хромосом - диплоидный набор (рекомбинация ДНК); регенерацию (восстановление стенки протопласта). Полученный гибрид засевают на плотную питательную среду. Чтобы отличить гибридную клетку от негибридной, необходимо на 4-й стадии включить еще один протопласт, несущий маркер. Маркер - это участок гена, кодирующий образование какого-либо фермента, который «заявляет» о себе при высеве на питательную среду, например маркер β-лактамаза. Если в питательной среде находится бензилпе-нициллин, то вырастут только клетки, содержащие β-лактамазу, а это могут быть только клетки-гибриды. При протопластировании и слиянии протопластов может происходить явление амплификации (увеличения) количества генов. Например, если амплифицируется ген, ответственный за синтез целевого продукта, то выход последнего (витамины, гормоны, антибиотики) соответственно увеличивается. Задача 9. В современной биотехнологии при создании ЛС особое место отводится генной инженерии, суть технологии которой заключается в искусственном соединении отдельных фрагментов ДНК invitro с последующим введением изолированной ДНК в живую клетку с целью получения рекомбинантных белков. Для осуществления этого необходимы определенные условия, наличие транспортного устройства для внесения ДНК в клетку продуцента, использование ферментов для включения нового гена. Генная инженерия оперирует такими понятиями, как вектор, рестриктазы, липкие концы, сайт узнавания, лигазы, ген-маркер, компетентность клетки, экзон, интрон. С представленных общих позиций по генной инженерии сформулируйте конкретные условия: —расшифруйте понятие «вектор» и пути его введения в клетку; предложите ферменты, работающие в этой ситуации; —предложите технику генно-инженерного эксперимента (стадии); —сравните процесс образования мРНКу эукариот и прокариот. Цели генной инженерии - создание новых продуцентов целевых продуктов (новые ЛС, диагностические и профилактические препараты). Суть технологии - соединение фрагментов ДНК invitro с последующим введением изолированной ДНК в живую клетку посредством ферментов эндонуклеаз, в частности рестриктаз. Техника генно-инженерного эксперимента Получение чужеродного фрагмента ДНК для последующей вставки его в клетку хозяина. - Выделение плазмиды из клетки-донора (например, Е. соli). - Конструирование рекомбинантной плазмиды (вектора). Векторрекомбинант (плазмида в виде фага- или изолированной ДНК, или вируса) получают с помощью фермента рестриктазы, рарезающей фосфодиэфирные связи в строго определенном месте последовательности оснований нуклеотидной цепи (сайт узнавания). При этом образуется два липких конца. Далее следует стадия отжига - процесс смещения двух фрагментов ДНК, при котором восстанавливаются только водородные связи. Для восстановления фосфодиэфирных связей используют ферменты ДНК-лигазы, которые «сшивают, склеивают» молекулы ДНК. Включение вектора в клетку хозяина. Вектор включается в клетку хозяина при условии, если- цитоплазматическая мембрана близко подходит к клеточной стенке, тогда вектор проникает внутрь клетки через так называемые окошечки, которые образуются при обработке ее ферментами, в результате чего эта клетка становится компетентной. Отбор гибридных клонов. Проводят посев на питательную среду, содержащую, например,- антибиотик бензилпенициллин. При этом вырастают только клоны, имеющие в своем геноме генмаркер, кодирующий синтез, например, фермента β-лактамазы. Ген-маркер заранее внедряется в геном гибриднойплазмиды. В процессе образования молекулы мРНК имеет место процесс сплайсинга (сращивания). Уэукариот, в отличие от прокариот, ген представляет собой мозаичную структуру, содержащую наряду с экзонами (последовательности оснований, несущие информацию) интроны (последовательности оснований, не несущие информацию). Однако фермент РНК-полимераза катализирует транскрипцию как экзонов, так и интронов. В процессе сплайсингауэукариотинтроны с помощью ферментов вырезаются, а экзоны после удаления интронов сращиваются. При этом образуется функционирующая (зрелая) мРНК. Упрокариот нет такого процесса (так как их гены не содержат интроны), и образующаяся в результате транскрипции молекула мРНК сразу же способна к функционированию. Задача 10. Возникновение таких новых дисциплин, как геномика и протеомика, является настоящим прорывом в биологии и имеет большое значение при создании новых, более эффективных ЛС. Если геномика обозначает совокупность всех генов организма, то протеомика подразумевает совокупность всех каталитических и структурных белков в клетке эукариота или прокариота. Задача геномики - полная генетическая характеристика именно всей клетки. Геномика позволяет выразить сущность организма, его видовые и индивидуальные отличия, предвидеть реакцию на внешние воздействия. Геномика имеет свою классификацию, открывает новые возможности для генотерапии, создания нетрадиционных ЛС, таких, как антисмысловыеолигонуклеотиды. Задача 11. Задача 12. Довольно часто при получении ЛС биотехнологическими методами синтез метаболитов в суспензионной культуре останавливается на промежуточных этапах, не доходя до целевого продукта. В этом случае на помощь приходит биотрансформация (биоконверсия), которая особенно эффективна в бактериальных клетках, но в ряде случаев такой процесс можно провести и с помощью культур растительных клеток, осуществляющих самые различные реакции биотрансформации, такие, как гидроксилирование, изомеризация, этерификация и т.д., что в результате приводит к структурно-функциональным изменениям трансформируемого химического соединения. Успешно применяют биотрансформациюкарденолидов, гликози-ды которых широко распространены в практике лечения болезней сердца. В качестве примера можно привести биотрансформацию растения DigitalisLanata. Задача 13. Биотехнологические методы получения ЛС на основе культур клеток растений имеют широкое распространение, поскольку по сравнению с получением биомасс растительных культур из дикой природы или с плантаций эти методы отличаются высокой рентабельностью, экологичностью, независимостью от географии и климата произрастания того или иного растения, а также обеспечивают высокое качество целевого продукта, стабильность производства и возможность управления процессами (автоматизацию). Все вышеперечисленное указывает на высокую перспективность дальнейшего развития данных методов. Анализируя данную ситуацию: · представьте технологии получения лекарственных препаратов растительного происхождения с конкретными примерами, обращая внимание на специфику растительных клеток, фазы роста, питательные среды, условия ферментации и типы биореакторов; · сопоставьте стабильность процесса по выходу вторичных метаболитов с дифференцировкой клеток и со стадией культивирования (фазы роста клеток); · предложите метод использования ферментов для превращения дигитоксина в дигоксин (последний менее токсичен и поэтому его применяют в качестве сердечного препарата - карденолида). Ответ: Метод биотехнологии получения ЛС на основе культур клеток растений начинается с процесса получения культуры каллусной ткани или каллуса. Каллус - ткань, возникающая при неорганизованной пролиферации клеток растения (дедифференцированное деление клеток). Метод реализует способность любой клетки образовывать полноценное растение в соответствии с ее генетическим и физиологическим потенциалом (естественными возможностями). Эта способность называется «тотипотентность». Стабильность по выходу целевого продукта (вторичных метаболитов) обычно связывают с дифференцировкой клеток и со стадией культивирования (конец экспоненциальной стадии с переходом на постоянную фазу роста и деления клеток). Примером влияния дифференцировки клеток на выход целевого продукта служит дифференцированный корневой каллус Atropabelladonna, синтезирующий тропановые алкалоиды (в отличие от недифференцированного). Другой пример: только недифференцированные клетки Rauwolflaserpentine синтезируют индолиловые алкалоиды. Технология получения каллуса требует наличия молодых и здоровых клеток, стерильности, определенной температуры (+24-26 °С) и влажности (65-70%), аэрации, соответствующего оборудования (специальные ферментеры). В питательную среду, помимо микро- и макроэлементов, источников углерода, витаминов, нужно вносить регуляторы роста растений - ауксины (индолилтриуксусная кислота и др.) и цитокинины (6-бензиламинопурин и др.). Также весьма существенную роль для синтеза метаболитов играют предшественники. Так, добавление фенилаланина увеличивает выход диосгенина на 100%. Накопление вторичных метаболитов зависит от того, на каких средах (жидких или твердых) проводят культивирование. Суспензионное культивирование осуществляют в аэрлифтных ферментерах без механической мешалки (с турбинным перемешиванием, с внешней циркуляционной петлей). Растительные клетки в отличие от клеток микроорганизмов имеют большие размеры, вакуоль, целлюлозную клеточную оболочку, клеточные агрегаты. Все это требует системы перемешивания восходящими потоками воздуха (встряхиванием без механических повреждений). Как правило, для этого используют следующие режимы культивирования: периодический (чаще), циклический и непрерывный (нарастание биомассы коррелирует с синтезом вторичных метаболитов). Для повышения выхода продуктов вторичного метаболизма применяют иммобилизацию растительных клеток. Иногда конечный продукт биосинтеза необходимо частично преобразовать. В этом случае применяют биотрансформацию - метод, использующий ферменты клеток растения, способные менять функциональные группы добавленных извне химических соединений. Примером применения биотрансформации служит превращение дигитоксина в дигоксин в реакции 1, 2-гидроксилирования, катализируемой ферментом, продуцируемым недифференцированными клетками DigitalisLanata. Задача 14. В процессе промышленного производства аскорбиновой кислоты используют многостадийный химический синтез, в который наряду с тонкими химическими реакциями встроена и технологически необходимая биосинтетическая реакция, что является одним из примеров успешного сочетания органического синтеза с биосинтезом. При проведении технологического этапа биосинтеза на производстве применяют определенные микроорганизмы, осуществляющие биосинтетические реакции. Не менее важными являются оптимизация условий ферментации и контроль за количеством биомассы микроорганизмов в ферментационном аппарате. Проанализируйте ситуацию с точки зрения: · химической реакции биотрансформации, определяющей проведение биосинтеза и получение ожидаемого результата при осуществлении биотрансформации; · выбора микроорганизмов для биоконверсии и оптимального подбора компонентов питательной среды (источников углерода, азота и фосфора); · возможности увеличения выхода целевого продукта. Ответ: Синтез аскорбиновой кислоты по А. Грюсснеру и М. Рейхшейну с 1934 г. представляет собой многостадийный и преимущественно химический процесс, в котором имеется лишь одна стадия биотрансформации D-сорбита в L-сорбозу с участием уксуснокислых бактерий как классический пример микробиологического производства. Для получения сорбозы культуру продуцента Gluconobaderoxydans выращивают в ферментерах периодического действия, оснащенных мешалками и барботерами для усиления аэрации в течение 20-40 ч. Выход сорбозы достигает 98% от исходного сорбита. Питательные среды содержат кукурузный или дрожжевой экстракт (20% от общего количества). По окончании производственного цикла сорбозу выделяют из культуральной жидкости. Совершенствование этой стадии в части повышения выхода целевого продукта при переходе от периодического культивирования продуцента Gluconobacteroxydans к непрерывному в аппарате колонного типа позволило увеличить скорость образования сорбозы в 1,7 раза. Также можно привести пример получения 2-кето-β-гулоновой кислоты (промежуточный продукт синтеза витамина С), которая легко превращается в аскорбиновую кислоту. Это метод двух-стадийного микробиологического синтеза, включающий окисление D-глюкозы в 2, 5-дикето-О-глюконовую кислоту с дальнейшейбиотрансформацией в 2-кето-β-гулоновую кислоту. Наиболее продуктивными микроорганизмами, осуществляющими эту реакцию, являются представители родов Acetobacter, Erwinia, Gluconobacter, в частности мутантный штамм Erwiniapunctate, который обеспечивает выход до 94,5% 2, 5-дикето-О-глюконовой кислоты от общего количества исходной глюкозы. Задача 15. При получении штаммов суперпродуцентов аминокислот, таких, как треонина или лизина, используют микроорганизмы Escherichiacoli, Corynebacteriumglutamicum, Brevibacteriumflavum, Bacillussubtilis. В одном случае биосинтез аминокислоты идет одновременно с ростом биомассы (путь получения аминокислоты одностадийный), в другом случае сначала идет рост биомассы и только потом синтез аминокислоты (путь двухстадийный). В данной ситуации получения аминокислот обоснуйте: - преимущества биосинтеза перед органическим синтезом и подбор соответствующих микроорганизмов для получения штаммов-продуцентов, способных к сверхсинтезу нужной аминокислоты, если конечным продуктом будет лизин или треонин: · выбор пути биосинтеза для лизина или треонина и особенности питательных сред; · условия ферментации (подготовительная стадия и биосинтез). Ответ: Современными методами тонкого органического синтеза можно синтезировать D и L-формы аминокислот в любых количествах, но все существующие способы их производства приводят к образованию рацематов. Таким путем можно получать рацематы лизина, глутаминовой кислоты, триптофана и других аминокислот. Вместе с тем химический синтез невозможен без достаточно большого количества агрессивных и токсичных веществ, что требует проведения дополнительных организационных мероприятий и финансовых затрат для их утилизации. Кроме того, подобные соединения небезопасны для персонала. Получение 100% биологически активной L-формы аминокислот методом органического синтеза - процесс очень сложный и экономически оправдан лишь в редких случаях. Альтернативой химическому синтезу служит микробиологический процесс, при котором специально подобранные селекционные или сконструированные методами генной инженерии штаммы-продуценты способны осуществлять сверхсинтез аминокислот, например L-лизина, L-глутаминовой кислоты, L-триптофана, L-треонина в значительных количествах, что является определяющим фактором при выборе технологиипроизводства аминокислот в промышленном масштабе. Однако при биосинтетическом получении в фармацевтической промышленности товарных форм L-аминокислот для кормового, пищевого или медицинского применения необходимо также использование тонкого органического синтеза на стадиях выделения, концентрирования и очистки субстанций аминокислот. Микробиологическое промышленное производство L-аминокислот можно осуществлять по двум технологическим схемам. Двухступенчатый способ предполагает образование и подготовку предшественника, а также биосинтез ферментного препарата микробного происхождения, который будет трансформировать предшественник в целевую аминокислоту. Это первая ступень. Вторая ступень - собственно процесс трансформации полученного на 1 стадии предшественника в аминокислоту с помощью ферментных систем микроорганизмов. Таким путем получают, в частности, L-лизин. Одноступенчатый способ синтеза аминокислот с помощью микроорганизмов основан на культивировании строго определенного штамма-продуцента целевой аминокислоты на среде определенного состава при соответствующих параметрах ферментационного процесса. Промышленный штамм должен обладать способностью к сверхсинтезу нужной аминокислоты. Для этой цели выбирают полиауксотрофные мутанты, т.е. те клетки микроорганизмов, которые, с одной стороны, утратили способность самостоятельно синтезировать необходимые для роста и развития клетки различные аминокислоты, а с другой - приобрели способность к сверхсинтезу целевой аминокислоты. Микроорганизмы осуществляют контроль биосинтеза каждой аминокислоты по принципу обратной связи как на уровне генов, ответственных за синтез соответствующих ферментов (репрессия), так и на уровне самих ферментов, способных при избытке аминокислоты изменять свою активность (ретроингибирование), что совершенно исключает перепроизводство аминокислоты клеткой в природных условиях. Из этого следует, что целью биотехнолога является нарушение этих систем регуляции с дальнейшим отбором ауксотрофных мутантов на селективных средах с использованием мутагенов (УФ, рентгеновские лучи, нитрозосоединения и др.). Такие мутанты имеют в геноме дефектный ген, детерминирующий фермент, без которого не может осуществляться биосинтез определенной аминокислоты. Важно, что получение ауксотрофных мутантов-продуцентов аминокислоты возможно только для микроорганизмов с разветвленной цепью биосинтеза, т.е. по крайней мере две аминокислоты должны синтезироваться из одного предшественника. У таких ауксотрофных мутантов избыток одной аминокислоты при дефиците другой не приводит к подавлению активности первого фермента. Однако аминокислота, биосинтез которой нарушен, должна быть добавлена в ограниченном количестве (при синтезе лизина добавляется гомосерин или треонин на 1-й стадии). Продуцент лизина – Corynebacteriumglutamicum (коринебактерии) - имеет единственную р-аспартакиназу (фермент), активность которой регулируется путем согласованного ингибирования по принципу обратной связи. Этот мутантный штамм-продуцент является ауксотрофом по гомосерину и треонину. Для длительной работы ауксотрофных штаммов-продуцентов лизина в питательную среду вносят белковые гидролизаты в режиме дробной подачи (комплекс аминокислот). Для получения L-треонина используют промышленный мутантный штамм Ксоli (энтеробактерии), где система регуляции биосинтеза аминокислоты основана на принципе дифференциальной регуляции изоферментами. Этот штамм - тройной ауксотроф. У него изменен 1 фермент цепи биосинтеза (нечувствительный к треонину), отсутствуют механизмы репрессии («хроническое голодание» по изолейцину), при помощи методов генной инженерии треониновые гены размножены на плазмидах, что значительно увеличило продуктивность штамма. При получении аминокислоты методами прямого микробиологического синтеза применяют полупериодическую ферментацию (регулируемую) с хорошей аэрацией (барботер) и перемешиванием (мешалка). Задача 16. Как известно, производство витамина В12 (кобаламин*) является чисто биотехнологическим способом его получения, когда в качестве продуцента данного витамина используют пропионовые бактерии из рода Propionibacterium, выращиваемые на богатой среде в определенных условиях ферментации с обязательным добавлением предшественника витамина В12 - 5, 6-диметилбензимидазола. В этой ситуации: · сделайте оптимальный выбор метода ферментации и условий ее проведения; · докажите необходимость добавления 5,6-диметилбензимидазо-ла в определенное время после начала ферментации и предупредите образование коферментной формы витамина В12;
|
|||||||||
|
Последнее изменение этой страницы: 2021-01-08; просмотров: 1518; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.45.92 (0.085 с.) |