
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Характеристики глиноземсодержащих материалов
Отечественные стекольные заводы получают КПШС с обогатительных фабрик как продукт переработки исходного сырья (нефелиновые и пегматитовые жилы) с целью извлечения более ценных материалов. Широкое использование имеет полевошпатовый концентрат Вишневогорского месторождения (Челябинская обл.), содержащий 95–97% полевых пшатов и 3–5% биотита, а также примеси мусковита, циркона, эгирина. Его химический состав (мас. %) после обогащения следующие: SiO2 – 65–68; А12О3 18,3–21,4; Na2O + K2O – 11,6–15,6; Fe2O3 – 0,6; MgO – 0,01. Сырье поставляется на стекольные заводы в молотом виде. Просеивают концентрат через сито 100 отв./см2 (№ 07). Влажность готового материала – 0,5%. Пегматитовое сырье также представляет собой обогащенную размолотую породу. Основной источник – Кондоложский завод в Карелии. Пегматит имеет следующий состав: SiO2 – 72–79; Аl2О3 – 13–19; K2О 3–9,4; Na2O – 1,3–5; CаО – 1,07–1,14; MgO – 0,3–0,4. Технология обогащения включает дробление и размол исходного сырья, магнитную сепарацию для удаления соединений железа и просеивание. По техническим условиям после обогащения пегматит должен содержать: А12О3 ≥ 14%; Fe2O3 ≤ 0,25; K2O + Na2O ≥ 8,0. Сырье характеризуется следующим зерновым составом: фракция 0,8 мм 2–3%; менее 0,1 мм – 20–25%. Влажность готового продукта 0,2–0,3%. Основным недостатком поставляемого на стекольные предприятия полевошпатового и пегматитового сырья является их химическая неоднородность, в частности значительные колебания оксидов железа по отдельным партиям сырья.
Щелочесодержащее сырье
Данным типом материалов в состав стекла вводятся оксиды Na2O и K2O с целью облегчения варки и обеспечения стеклу должных технологических свойств. Основным источником щелочных оксидов в стеклоделии являются: кальцинированная сода, сульфатнатрия, поташ, содосульфатная смесь. Кальцинированная сода в настоящее время является основным видом сырья для ввода в состав стекла Na2O. Это продукт, получаемый синтетически по способу предложенному Солвеем из NaCl и аммиака в ходе следующих реакций:
– синтез гидрокарбаната в ходе реакции: NaCl + NH3 + CO2 + H2O → NaHCO3 + NH4Cl – кристаллизация NaHCO3 и отделение от маточного раствора; – кальцинация гидрокарбоната по уравнению 2NaHCO3 Получаемый в итоге продукт требует для своего получения значительных материальных и энергетических вложений и известен как легкая сода. Легкая сода имеет насыпную плотность около 0,5–0,7 т/м3 с доминирующим размером частиц 0,4 мм. При ее использовании в шихте наблюдается сильное пыление при транспортировке, загрузке в печь и варке, в результате чего нарушается химический состав стекла, наблюдается быстрое разрушение огнеупоров сыпочной арки печи, а также первых по ходу влетов горелок регенераторов. Поэтому обозначена тенденция использования в стекольной промышленности «тяжелой кальцинированной соды. Она получается на предприятиях-про- – повышение теплопроводности шихты на основе более плотной тяжелой соды, что способствует ускорению стеклообразования при варке; – снижается пыление шихты; – уменьшается гигроскопичность соды, приводящая к потере ее качества при хранении, а также усиливающая склонность шихт к комкованию, то есть повышается однородность и стабильность состава шихты. Сода является критическим компонентом стекольных содоизвестковых шихт, поскольку ее использование сопряжено с некоторыми сложностями. Выше отмечена ее гигроскопичность, однако этим дело не ограничивается. При температуре ниже 105°С происходит химическое взаимодействие междуNa2CО3 и H2O с образованием моногидрата Na2CO3 · H2O. При наличии достаточного количества воды и понижении температуры ниже 35,4°С поглощается еще 6 молекул H2O с образованием гептагидрата Na2CO3 · 7Н2О и, наконец, при температуре ниже 32°С сода поглощает еще 3 молекулы воды с образованием декагидрата Na2CO3 · 10H2O. Таким образом, охлажденная ниже температуры 35°С содокарбонатная шихта всегда будет сухой, поскольку введенная в нее вода с целью предупреждения пыления и расслоения, а также для ускорения протекания реакций стеклообразования будет химически связана. В связи с данным обстоятельством технологически обоснованным является поддержание температуры шихты выше 35°С. При этом сода, присутствуя в шихте в форме гидрата и в количестве около 20% по массе, связывает примерно 3% H2O. Практика шихтоприготовления же показывает, что присутствие 1,5% воды в капельном состоянии в шихте обеспечивает упомянутые выше эффекты Повышение этого количества вызывает лишь повышение затрат топлива на варку (за счет испарения лишней воды). Таким образом, оптимальная влажность содокарбонатных шихт составляет 4,5–5,0%. Оптимальная температура шихты 40–50°С.
Согласно ГОСТ 5100–85, содержание Na2CО3 в прокаленном продукте менее 98,2%, содержание хлоратов в пересчете на NaCl не более 0,5%, Fe2O3 <0,003, Na2SO4 <0,05. Основные предприятия-производи- Na2SO4 используется в настоящее время для интенсификации процесса осветления традиционных составов стекол для массовых производств, хотя реальная его роль значительно сложнее (см. раздел «Стекловарение»). Сущность сульфатного осветления выражается следующим уравнением: Na 2 SO 4 Особенностью сульфата натрия является его раннее плавление при t = 884°С (до разложения). Расплав сульфата, во-первых, является поверхностно-активным веществом, во-вторых, практически нерастворим в стекломассе (растворимость <1%). Часть расплава Na2SO4 адсорбируется на поверхности раздела с твердыми частицами (кварца), а также с пузырьками газа, снижая межфазное поверхностное натяжение. В итоге за счет смачивания нерастворенных зерен кварца стекломассой ускоряется процесс их растворения, а также рост газовых пузырей. Адсорбция расплава Na2SO4 на газовых пузырьках облегчает их рост за счет снижения поверхностного натяжения на границе стекломассы. Разложение Na2SO4, адсорбированного на зернах SiO2, при повышенной температуре приводит к интенсивному массообмену вблизи поверхности раздела твердое – жидкость за счет выделения и движения пузырьков («микросмешивающий эффект»). Для ускорения разложения сульфата в процессе варки и повышения степени однородности расплава (предупреждения образования «щелоков» – лужиц расплавленного Na2SO4 на поверхности стекломассы) в шихту добавляют восстановитель, чаще в виде угля. Протекающая при варке реакция
Na2SO4 + С приводит к образованию сульфита, который разлагается без плавления. Стекла, полученные в ходе такого «восстанавливающего» осветления, отличаются высокой устойчивостью к «вторичному» пузырю – вторичному выделению SO2 в виде пузырей. Проведение процесса восстанавливающего сульфатного осветления требует сохранения при температурах осветления достаточного количества неразложившегося Na2 SO4. Иначе говоря, при большой степени восстановления образуется сульфид Na2S. Сульфидная сера в присутствии железа образует комплексы, окрашивающие стекло в коричневые оттенки. В связи с истощением запасов кондиционного природного сырья cтекольные заводы перешли на применение синтетического сульфата натрия, являющегося побочным продуктом некоторых химических производств, например Могилевского и Светлогорского заводов химволокна. В соответствии с ГОСТ 6318-77, содержание основного вещества в сырье не менее 99,8%, Fе2О3 – не более 0,04%. К числу важнейших требований, предъявляемых к сырьевым материалам, используемым в производстве изделий из стекла, относятся стабильность их химического состава, а также химическая однородность. Первое требование относится к составу крупных партий сырья, прибывающих с месторождений и обогатительных фабрик и обрабатываемых на данном предприятии. Требование к химической однородности сырья включает сохранение стабильности состава данного вида сырья на всех стадиях производственного цикла хранения, обработки, транспортирования и др. Требования к однородности основных стекольных сырьевых материалов в производстве изделий из стекла определяются соответствующей нормативной документацией (табл. 6.8). Соответствие основного сырья приведенным требованиям является гарантией обеспечения постоянства состава получаемого на их основе стекла. Вклад колебаний состава исходных материалов в общую величину отклонения состава шихты от заданного может быть весьма значительным, что демонстрирует табл. 6.9.
Таблица 6.9
|
||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-12-09; просмотров: 151; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.96.146 (0.014 с.) |
|||||||||||||||||||||||||||||||||||||
 Na2CO3 + H2 ↑
Na2CO3 + H2 ↑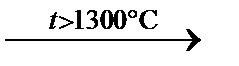 Na 2 O + SO 2 ↑ + 1/2 O 2 ↑
Na 2 O + SO 2 ↑ + 1/2 O 2 ↑ Na2SO3 + СO
Na2SO3 + СO


