
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет материального баланса химических реакцийСтр 1 из 9Следующая ⇒
Строение веществ В состав атомов входят: ядро и электронное облако. Электрон – это частица и волна. Ядро – состоит из протонов, и других элементарных частиц. Заряд ядра уравновешивается зарядом электронного облака, свойства атомов определяется количеством протонов и нейтронов в ядре. Атомы соединяющие одинаковое количество протонов соответствует определенный химический элемент. Химические элементы, окруженные электронным облаком – являются инертными, не реакционно способными. В зависимости от количества нейтронов при одинаковом количестве протонов, атомы имеют разный атомный вес, но являются атомами одного химического элемента и называются изотопами. Количество изотопов для каждого химического элемента различно. Атомный вес – это сумма весов всех элементарных частиц в составе ядра. А электронное облако по своему весу мизерно и его массой можно пренебрегать в расчетах. Рассчитывают средний атомный вес для всех химических элементов. Для выражения атомных весов принята условная единица – углеродная единица (у.е.) равная 1/12 части веса атома углерода, таким образом, вес одного протона равен весу одного нейтрона. Химические свойства элементов определяются количеством электронов во внешних слоях, способных образовывать электронные пары называются валентными. Их бывает от 1 до 8. Отсюда атомы одного элемента соединения с образованием молекул H2, N2, O2, когда один внешний электрон спаривается с другими. Вещества состоящие из 1-го электрона называют простыми. Закон сохранения вещества: при физических и химических превращениях, количество вещества остается неизменным. Количество атомов каждого из веществ участвующих в химических и физических перемещениях одинакого до начала и после окончания реакций. Тепловая энергия до начала и после реакции, так же неизменна. Масса и энергия в процессе химических превращений неизменна. Физические превращения, ядерная реакция приводит к изменению состава атомов с выделением или поглощением энергии. Самопроизвольное деление ядер характерны для некоторых изотопов – радиоактивны. Из радиоактивных – цезий, уран, свинец – есть в нашем производстве. Радиоактивные отложения в цехе имеются на фильтрах, емкостях, трубопроводах, по ходу движения подкисленных растворов (на металлических поверхностях).
Неорганические вещества: 1. Простые вещества: S32, Fe, H2. 2. Сложные вещества: окиси, в составе: H2O, FeO, B2O3; кислоты в составе: H3NO3 – азотная; HCl+H2O – соляная; H2SO4 – серная; H3BO3 – борная; HBO2 – метаборная; H2SiO3 – кремниевая; H2CO3 – угольная. 3. Основания: Ca(OH)2 – известковое молоко (гидроокись кальция), NaOH, Fe(OH)2, Fe(OH)3, HOH – вода (нейтральное вещество). Щелочными веществами называются гидроокиси щелочных металлов, именно металлы первой группы таблицы химических элементов. Всего 107 химических элементов. Металлы отдают электроны, неметаллы принимают электроны. Атомы, которые и принимают и отдают – амфотерные. Отрицательно заряженные частицы – кислотные остатки SO42-, гидроксильные группы OH–. Положительно заряженными – основные остатки, металл+ и гидроксы H3O+, Me+, (Na+, Fe+). Соли – в состав сходят щелочные и кислотные остатки. Соли бывают простые, когда один кислотный один щелочной остаток. Сложные – двойные, тройные. Сульфаты CaSO4 + nH2O, Fe2SO4. Силикаты CaSiO3 + nH2O – n-количество атомов воды. Все вещества могут находиться в разных модификациях – кристаллическое, аморфное, пластичное строение. Разное строение кристаллов, для одного и того же вещества (уголь, графит, алмаз). Алмаз – кристаллическое; уголь, графит – пластичное. Молекулы – характеризуются молекулярным весов, составом, строением. Молекулярный вес – это сумма атомных весов всех атомов в составе молекул. Строение – взаимное расположение атомов в пространстве. Строение веществ описывается с помощью знаком отображающих химические связи между атомами. Вещества бывают: мономерными и полимерными. В водном растворе борная кислота приобретает полимерное строение и образует до четырех мономерных звеньев. Химические связи внутри молекул, между атомами бывают двух типов: 1. Ионная связь – характерна для соединений явно выраженных металлов и неметаллов. Когда валентные электроны металла передаются частице или атому неметалла и возникают положительно и отрицательно заряженные частицы, притягивающие друг к другу = ионы.
2. Ковалентная связь – когда валентные электроны образуют совместную стабильную пару электронов одинаково притянутую к каждому из атомов. Взаимное расположение атомов кристаллической решетки плоское, объемное расположение связей передает разное физическое и химическое свойство вещества. Химическими реакциями называются превращения веществ с изменением состава молекул. Исходные вещества – это вещества вступающие в реакцию. Конечные вещества – это продукты реакции. Химические уравнения – это записанное с помощью химических и математических знаков, взаимодействие веществ и другие химические превращения. Типы химических реакций: реакция распада, реакция соединения, реакция обмена. В2О3 – борный ангидрид. В2О3 + 3Mg → 2B + 3MgO Бор трехвалентен, т.е. ему нужно добавить по три электрона, в молекуле 2 атома, т.е. не достает шесть электронов, Mg отдаст по 2 электрона, а т.к. нужно шесть электронов, то 6/2 электрона, получается 3 атома Mg. Бор Порядковый номер в таблице Менделеева 5. Электронные слои Участвуют в обращении связи 3 электрона. Изотопы 2, В10 его 19,61% от всех атомов в природе и В11 его 80,39%. В земной коре имеется 3∙10-4%, 0,003% от массы Земли. На всей Земле + вода 4∙10-4%, может быть аморфными или кристаллическими твердыми веществами. По химическим свойствам это неметалл, но слабее кислорода. Бор вступает в реакцию с металлами и водородом, получаются вещества бориды и отдельная группа бораны. to плавления аморфного бора 2072 oC, а кристаллического бора 2300 оС – это переход в жидкое состояние (плавление). to кипения 2550 оС – это тугоплавкое вещество. Плотность аморфного вещества 1,75 г/см3, для кристаллического 2,34 г/см3. Твердость по шкале Мооса составляет 9,5 ед. (максимум 10). В природе содержится в виде химических соединений, в виде минералов, а именно солей и чистой борной кислоты Н3ВО3. Соли называются бораты, полибораты, т.е. склонные к полимерным соединениям. Бура – Na2B4O7 ∙ 10H2O. Na2B4O7 ∙ 5H2O – кристаллогидраты. Всего известно 150 минералов. А у нас в городе: Датолит, химический состав CaHBSiO5. В его составе 6% бора, 2CaO ∙ B2O3 ∙ 2SiO2 ∙ H2O. Данбурит: CaO ∙ B2O3 ∙ 2SiO2 Горение бора: 4B + 3O2 = 700 oC → 2B2O3 ВО – окись 2-х валентного бора. Н2 + В → В2Н6, В4Н10, В5Н11, и т.д. – газы, если бор – бораны. В2О3 окись бора или борный альдегид – это могут быть стекловидные и кристаллические вещества, бесцветные, хрупкие, нелетучие, не проводят эл. ток и тепло, но очень гигроскопичное вещество, т.е. поглощает воду из воздуха и превращается в борную кислоту. to плавления 294 оС, to кипения 1500 оС, плотность 1,84 г/см3. Смешивается и растворяется в воде в любых пропорциях с выделением большого количества тепла. Теплота растворения 70,3 килоджоуля на 1 моль. 1 моль вещества – это количество вещества в граммах численно равное молекулярному весу. Молекулярный вес 69,62 В2О3.
ОН
О О Более сильная – К = 2∙10-4. Существует только в растворе. Н2В4О7 полиборные кислоты, двухвалентные – эти кислоты более сильные. При растворении в воде Н3ВО3 поглощается в тепло. to плавления Н3ВО3 – 181 оС, насыпной вес 0,7 т/см3, образует соли в основном с щелочными металлами и с кальцием. Многообразие солей – это метобораты MeBO2, тетробораты Ме2В4О7, пентобораты Ме2В5О7, октобораты Ме2В8О11. 3Н2О + В2О3 ↔ 2Н3ВО3 3∙18=54 69,62 2∙61,81
mB2O ∙ 1.776 = mH3BO3 коэффициенты пересчета mH3BO3 ∙ 0.562 = mB2O3 Количество коэффициента пересчета В2О3 в Н3ВО3 и наоборот в В2О3, таким образом: К1 =
К2 =
Таблица растворимости борной кислоты в воде
С увеличением to увеличивается растворимость и наоборот, при охлаждении раствора, молекулы из растворенного состояния выпадают в осадок, переходят в твердое состояние. На растворимость борной кислоты влияет присутствие примесей, некоторые уменьшают растворимость, а некоторые увеличивают. Н2SO4 и ее соли увеличивают растворимость борной кислоты, но если этих примесей будет много, это может привести к высаливанию борной кислоты. Хлорид лития, натрий хлористой кислоты, кроме Н2SO4 высаливают борную кислоту из раствора. Обратная растворимость характерна для гипса CaSO4 + 2H2O и повышает to от 40 до 80 оС, растворимость уменьшается. Гипс – примесь в наших растворах. Количественно растворимость выражается концентрацией. 1. Молярная концентрация – количество грамм молей вещества растворенного в одном литре раствора. Моль – это количество грамм вещества численно равное молекулярному весу. Для борной кислоты молекулярный вес равен 61,81 у.е. = 61,81гр вещества. Знак понятия концентрации буква С или [ ]. 2. Процентная концентрация – это количество грамм вещества находящихся в 100гр раствора. [В2О3] в основном растворе 6,03%. Например, показатель концентрации ионов (водорода) гидроксопия (рН). (Н3О+) = Н+ + Н2О + R-. HR – диссоциация кислоты, образование заряженных частиц в водном растворе.
Ионизация, т.е. образование заряженных частиц ионов. Степень диссоциации – это количество молекул претерпевших переход в ионы. Математический рН – это логарифм [Н2О+]. рН – это отрицательный, десятичный логарифм концентрации гидроксопия. Слабые кислоты потому и слабые, что мало разлагаются на ионы. Сильные кислоты, практически полностью переходят в ионы, если достаточно растворителя (воды). Концентрация H2SO4 – 94-98% – в этом состоянии кислота не активна. При разбавлении менее 40% начинается ионизация и кислота становится реакционно способной. Наличие заряженных частиц в растворе используется для измерения концентрации веществ, для выделения химических реакций с помощью эл. тока, растворы становятся электропроводными и вести различные процессы – электролиз, электрофорез и т.д. растворы веществ подразделяются на кислые, нейтральные, щелочные, в зависимости от СН+ и СН-.
Кислотная Нейтральная Щелочная
Н2О → Н3О- + ОН- Степень диссоциации воды 10-7% 4,7-4,8 – рН выщелачивания (28-х) 2,8 – рН (58-х). Известковое молоко Сырье для производства известкового молока: · Датолитовый концентрат; · Датолитовая руда; · Серная кислота. рН известкового молока – 12,0. Известковое молоко – это суспензия гидроокиси кальция (СаОН2) в воде. Готовится она в цехе №6. Минерал известняк содержит СаСО3 – 95-98% этого вещества в горной породе. На обогатительной фабрике его измельчают и в прокалочной печи ведут обжиг при to 960оС – термическое разложение. Получают две окиси: углерода и кальция. СаСО3 → СаО + СО2↑. Обжиг: загаска (СаО), окись кальция плюс вода СаО + Н2О → Са(ОН)2↓ – перекачивается на узел бората кальция. Са(ОН)2 + СО2 → СаСО3 + Н2О – на воздухе. Известковое молоко предназначено для получения соли борной кислоты в твердом виде, с целью регулирования водного баланса и получения нейтрализующего H2SO4 вещества. Внешний вид – это суспензия белого цвета, содержание СаО чистого (активного) должна быть 10-14%, содержание твердого вещества (примесей) менее 1%. Массовая доля содержания MgO – менее 0,3%. рН водного раствора СаОН2 равен 12 ед. растворимость очень маленькая, степень диссоциации тоже низкая – это слабая щелочь. Сильные щелочи NaOH имеют рН – 14ед. Первая помощь при ожогах известковым молоком: промывка водой, наложение компресса слабой кислоты (лимонная, молочная) и обращение к врачу. H 2 SO 4 – концентрация 94-98%, остальное вода. Маслянистая бесцветная зеленоватая или коричневатая жидкость, прозрачная. Удельный вес 1,84г/см3 или 1,84т/м3 при to 20оС концентрации 100%. to кипения 330оС, to плавления зависит от концентрации при 98% замерзает при -0,7оС, при разбавлении водой to замерзание ниже, при концентрации 94% замерзает при -31оС, а концентрация 100% при +10оС.
С водой H2SO4 смешивается в любых соотношениях с выделением большого количества тепла, диссоциируют полностью в водных растворах при низкой концентрации. рН H2SO4 – летуча, образуются аэрозоли. Она опасна, поражает органы дыхания, слизистые оболочки, она гидроскопична. При разбавлении с водой и попадании на кожу происходит химический и термический ожог.
H2SO4 должна быть без механических примесей. Концентрация H2SO4 – 94-98% Содержание Fe менее – 0,015% Мышьяка менее – 0,001% Хлоридов – 0,005% Тяжелых металлов – 0,01% Предельно допустимая концентрация (ПДК) в производственных помещениях менее 1 мг/м3 из-за своей опасности. Производство H2SO4 в цехе №19. Комовая сера плавится, фильтруется, сжигается и получается сернистый газ, который далее окисляется на катализаторе SO3 + H2O абсорбция → H2SO4 жидкая. H2SO4 может растворить в себе сернистый газ. Датолитовая руда Химический состав: чистый минерал, бледно-зеленый, прозрачный кристалл. Содержит бор 21,8%, СаО – 35%, SiO2 – 37,6%, Н2О – 5,6%. Сопутствующие минералы: кальцит, кварц, гранат и т.д. Из металлов: кальций, алюминий, марганец и т.д. Тяжелая фракция: содержит металлы. Легкая фракция: содержит кальциты Средняя фракция: содержит датолит и т.д. Размер 10-35 мм направляется в корпус 4 цеха №7 для термического разложения, в ходе которого, получается, спек датолитовой руды, to процесса 960-1000оС. Исходная руда содержит не менее 8-12% В2О3. В стандарте не менее 13%. Разложение датолита: 2СаОВ2О32SiO2H2O → CaOB2O3 + CaOSiO + H2O Окиси металлов Fe: FeO, Fe2O Обжиг ведется в прокалочной печи. После этого спек смешивается с промывочным раствором из позиции Н1 корпус 2 содержащий В2О3 – 1,5-2,1%. При контакте спека с раствором образуются дополнительные твердые соли борной кислоты, а именно СаО + Н3ВО3 → СаО ∙ В2О3 ∙ Н2О. концентрация В2О3 в растворе уменьшается на 0,1-0,5%, пульпа спека направляется в цех №6 в сгустители, отстаивается и сгущенная твердая фаза с плотностью 30-35% твердого откачивается в реакционное отделение корпус 2 в позицию 8.1 и перекачивается в позицию 12 в расходную емкость бората кальция для узла выщелачивания 70-65% жидкого раствора В2О3, концентрация от 1-1,7%. Из сгустителя основной раствор направляется на стадию осаждения в реакторе цеха №6 с получением бората кальция в реакции: Н3ВО3 + Са(ОН)2 → СаО ∙ В2О3 ∙ 6Н2О; 6Н3ВО3 + 2Са(ОН)2 = 2СаО ∙ 3В2О3 ∙ 9Н2О. После реакторов суспензия подается в два других сгустители, осветленная часть (маточник) перекидывается в корпус 2 цех №7 в позицию 58, сгущенная часть откачивается через позицию 3-50 в сборник 3-72 узла бората кальция корпус 3 цех №7 для переработки с целью отделения маточного раствора. Влажные кристаллы смешиваются с грязным основным раствором и перекачиваются в позицию 12. Спек согласно стандарту, степень перехода не менее 92%, В2О3 не менее 13,5%, остаток на сите размером более 0,074мм должен быть ≤ 5%. рН пульпы – 6,7-7,5 ед., содержание твердого > 30%. Соотношение твердого к жидкому не менее 1:3 по весу. Степень перехода – это количество молекул датолита, прошедших разложение в прокалочной печи, т.е. из 100 шт., 93 должно быть разложено. Помол после прокалочной печи, спек измельчается в мельнице с помощью шаров.
Минеральный состав: Химический состав: Датолит – 86% В2О3 – 18,67% Кальцид – 8% F2O3 – 1,8% Гранат – 4% CaSO3 – 7,7% Бифоксин – 1% SiO2 – 35% Кварц – 1% Гинзенгерит – 0,5% Волостонит – 0,5% По стандарту: B2O3 – более 18% CaSO3 – от 4 до 10% Fe2O3 – менее 2,3% Твердая фаза в пульпе – 50-60% Остаток на сите размером 0,07мм менее 25% Под ситом менее 0,071мм должно быть 74% ПДК пыли 4мг/м3, дотолитовой руды 2мг/м3. Перекачка производится центробежными насосами по трубопроводу, при этом уклоны трубопроводов должны обеспечивать самостек пульпы после остановки насоса. При остановке необходимо, особенно в зимний период, производить продувку трубопроводов сжатым воздухом не допуская оставления в них жидкостей и твердой фазы, а так же исключая намерзания влаги из воздуха. Фильтроткань капрон артикул 56.007, чулки, рубашки, салфетки. Ткань артикул 56-385. ТСКФ – рубашки. Воздухопроницаемость – количество воздуха при испытании проходящее в дм3 через 1м2 ткани в секунду. Для капрона 56.007 нормой является от 80-150 дм3/м Для ТСКР – 200-300 л/м2 Для бельтинга – 6-10 л/м2
Пульпа ДК Этап приготовления пульпы дк с заданной плотностью to, для этого установлены дк. Предназначены для разделения воды и дк с последующей доводкой пульпы до заданной плотности. В ходе фильтрации на дк образуется осадок на ткани, который переносится при вращении вала из корыта в репульпатор (осадок на фильтроткани – кек). Кек сбрасывается с фильтроткани во время отдувки с помощью сжатого воздуха в емкость под названием репульпатор, где с помощью мешалок смешивается с маточным раствором борной кислоты из позиции 65.3 в заданном количестве. Расход маточника регулируется пневмоканалом по сигналу от плотномера установленного на сливе с репульпатора. Это первый контур разбавления. Конечное разбавление производится добавкой маточника с помощью регулируемого клапана, по управляющему пневмосигналу радиоактивного плотномера. Вода откачивается на обогатительную фабрику, пульпа сливается в сборник. Фильтрат проходит через фильтроткань во внутрь сектора установленного через бобину к каналу 12 ячейкового вала. Под воздействием разряжения создаваемым вакуумным насосом, при вращении вала сектор выходит в атмосферу и находясь в разряжением через ткань осадок просушивается воздухом, воздух захватывает частицы воды и движется к вакуумному насосу. В зоне сушки канал вала подсоединяется к части распределяющей головки куда подается сжатый воздух с давлением 0,2-0,3кг выше атмосферного. В это время фильтроткань освобождается от твердого осадка сбрасываемого в репульпатор, далее сектор входит под слой пульпы и опять соединяется через распределяющую головку подается к вакуумной магистрали. В зоне фильтрации находится одновременно 5 секторов, в зоне сушки – 5 секторов, в зоне отдувки – 2. Фильтрат, пройдя распределительную головку из зоны фильтрации сушки объединяется в трубопроводе и поступает в вакуум приемник, где происходит отделение паровоздушной смеси от жидкости, которая сливается по трубопроводу в барометрический ящик (б/я), предназначенный для создания гидрозатвора (водяного затвора) между воздухом атмосферным и вакуумной схемы. Объем б/я должен обеспечивать количество воды на заполнение трубопровода до вакуум приемника, на высоту не менее 10 м, т.е. на силу атмосферного давления. Из б/я фильтрат сливается в сборник или в репульпер. Внутри вакуум приемника давление ниже атмосферного, водяной столб в сливном трубопроводе относительно жидкости в ящике в зависимости от стенки разряжения, чем выше разряжение, тем выше водяной столб. Максимально возможное разряжение (абсолютный вакуум) – 1кг, соответствует высоте столба в 10м. В условиях пониженного давления внутри деталей дк в вакуум приемнике и т.д., вода испаряется, чем глубже разряжение тем больше испаряется вода и давление возрастает, разряжение падает, кроме того через фильтр прокачивается воздух, что ведет к падению разряжения. При конденсации воды (из газа в жидкость, из пара в жидкость) объем газа уменьшается, уменьшается давление, увеличивается разряжение. Вакуумный насос прокачивает воздух. Барометрический конденсатор, должен обеспечивать полную конденсацию водяного пара для увеличения главной задачи – создания вакуума насосами. Конденсация происходит при контактах его со струями и брызгами холодной воды льющейся сверху вниз, для увеличения контакта установлены полки, тарелки, воронки в зависимости от типа конденсатора. Отработанный воздух после ВВНа в воздух. Разряжение зависит от работы вакуумных насосов. Герметичность системы в том числе отсутствие свищей и наличие гидрозатворов, состояние дк. Производительность дк зависит от неплотности (подсосы) на соединениях сектора с валом, вала с распределяющей головкой, распределяющей головки со сливными трубопроводами, от целостности ячейкового вала – все это от разряжения внутри секторов, от поверхности фильтрации реально работающей. Необходимо своевременно удалять сектора для чистки, имеющие уменьшение диаметра отверстия от 6-7мм до 5мм и менее. От состояния фильтроткани, чем больше воздухопроницаемость, тем больше фильтрат пройдет через все сектора в единицу времени. От свойств пульпы, а именно: чем больше to тем больше производительность. Гранулометрический состав (размер частиц) чем крупнее, тем больше пропускают воду и таким образом производительность уменьшается при увеличении толщины слоя. Снижаемость осадка (слипание) CaSiO3, CaSO4, H2SiO3, Fe(OH)2. Состояние фильтроткани: воздухопроницаемость л/м2 в секунду. По ходу эксплуатации усаживается, размеры ячейки уменьшаются. На поверхности фильтроткани образуются не снимаемые осадки. При нарушениях технического режима осаждаются некоторые вещества на поверхности ниток фильтроткани и пропускаемая способность ее уменьшается. В случае прорыва фильтроткани: острые поверхности фильтровальных элементов, т.е. фильтроткань не является перегородкой при порыве. Фильтрация – это процесс разделения жидкой и твердой фазы через перегородку под воздействием: сил тяжести (отстойное фильтрование), разряжения, давления, центробежных сил. При этом в фильтрате находится твердая фаза, что не желательно или не допустимо, ухудшается качество продукции, уменьшается производительность. Пять стадий промывной фильтрации работают на дисковых фильтрах. Стадии производства борной кислоты: Получение спека датолитовой руды – термическое разложение. Разложение дк H2SO4 – сернокислотное разложение. Выщелачивание камерного продукта оборотными растворами. Получение основного раствора и его очистка на 3-х контурных фильтрациях. Охлаждение продукционного раствора для кристаллизации борной кислоты. Предварительное сгущение суспензии и фубовка. Сушка кристаллов борной кислоты, очистка газа и упаковка готового продукта. Осаждение боратов кальция. Промывка шламов с получением промышленных растворов. Разложение дк Приготовление пульпы ведется для замены воды на маточный раствор борной кислоты. Для заданного количества твердой фазы в пульпе с целью более эффективной переработки в зависимости от состава. Для подогрева пульпы с целью более полного разложения. Расход маточника примерно 20м3/ч; to 45оС, to пульпы 10оС. Подогрев 35-40оС в позиции 1-1, плотность готовой пульпы 165-172 кг/л. Методика: в мерную емкость заливается пульпа, взвешивается вместе с емкостью, вес емкости вычитается, чистый вес пульпы делится на объем, по таблице смотрим строку, в литре 1,7кг соответствует 61% твердого в пульпе. Исходная пульпа насосом подается в напорный бак, из которого часть направляется в расходный бак и далее с помощью регулировочного клапана, в заданном количестве поступает в смеситель, где сливается с заданным количеством H2SO4. Избыток пульпы из обоих баков возвращается в исходную емкость в позицию 1. От расходного бака (бак автоматики) пульпа самотеком спокойно через заборный патрубок стекает. Важно стабильное количество пульпы поступающей в заборный бак. Дозирование пульпы и кислоты должно быть таким, чтобы в результате серно-кислотного разложения из датолита большая часть борсодержащей соли вступила в реакцию (не менее 97%). В полимерном продукте был бы избыток H2SO4, влажность продукта обеспечивала его рыхлость, измельчаемость и продукт не выливался бы из супер камеры. Влажность должна быть 17-19% это количество воды. В 100гр продукта 19гр воды, избыточная H2SO4 – 1.5-3.5%. Соотношение расхода H2SO4 к расходу дк должна быть примерно 0,60-0,70. Для контроля процесса есть точки отбора: слив из смесителя, ленточный конвейер, продукта выгружаемого из супер камеры (визуально). На сливе из смесителя замеряется время схватывания и to. В смесителе исходные вещества и реакционная масса находится 4-5 минут, происходит перемешивание, разогревание теплом от смешивания воды и H2SO4 и от других химических реакций. Время схватывания должно быть 20-40 сек, после выхода из смесителя, to смеси 120-125оС. Условия разложения в камере не менее 1ч. Если время схватывания более 40 сек, то процесс разложения может не пройти полностью. Для этого нужно повысить to, плотность исходной пульпы. Охлаждение реакционной смеси происходит за счет количества испаряющейся влаги. Если время схватывание мало, то полноты разложения не будет, продукт жесткий и не будет измельчаться, нужно увеличить количество воды. Разложение идет в системе, объем его 1,5м3 в течение 3-5мин. Суперфосфатная камера ее объем 75м3, рабочий объем 40м3. В смесителе на 50% проходит реакция и затем в камере в течение 1ч происходит остальные 50% реакций. Степень заполнения камеры зависит от скорости ее вращения и от часовой нагрузки по твердому. Скорость вращения камеры от 1ч 30мин до 1ч 45мин. Из смесителя реакционная масса в полужидком состоянии сливается через порог в вертикальный канал в камеру, изготовленную в виде цилиндра с днищем, по центру которого имеется выгрузная труба. Камера установлена на фундаментах с роликами. Вращение производится за счет зубчатой передачи от эл. двигателя. На крышке установлен смеситель с мешалкой и подвешена карусель, устройство для удаления затвердевшего камерного продукта. Это цилиндр с помощью тяг и вала подвешенный к крышке камеры со скоростью вращения 6,5 оборотов в минуту. На внешней и внутренней части цилиндра установлены ножи и скребки, с помощью которых камерный продукт, вращаясь вместе с камерой, продвигается к карусели и вырезается, подхватывается скребками к выгрузной трубе и высыпается на ленточный конвейер для транспортировки на узел выщелачивания. Причины пролива супер камеры: низкая плотность пульпы (большое количество воды). Лишняя кислота. К крышке закреплена перегородка в виде дуги с лепестками из особой стали для создания уплотнения между перегородкой и стенкой, перегородкой и днищем супер камеры. Назначение камеры – это ведение разложения дк с получением качественного камерного продукта. Качественный камерный продукт – кусочки небольшого размера – 5см, рыхлый, ломкий, серого цвета, не влажный, не липкий, не твердый без посторонних примесей. Степень разложения датолита 97%, избыточная кислотность от 1,5 до 3,5% H2SO4, влажность 16-19% и степень коагуляции кремниевой кислоты (H2SiO4) более 70%. Коагуляция – это процесс разложения H2SiO3 за счет высокой to в ходе которого удаляется полностью или частично влага удерживаемая молекулой H2SiO3 с образованием кристаллической H2SiO3. Это необходимо для обеспечения фильтруемости пульпы на стадиях фильтрации. Если не будет избытка H2SO4 то процессы разложения полностью не пройдут, при этом продукт будет иметь желтый или коричневый оттенок. Отходящие газы при процессах разложения содержат воздух в смеси с водой, углекислым газом, пылью, аэрозоли борной кислоты и H2SO4, to больше 100%. По закону, содержание их в выбросе должно быть не выше предельно допустимых для каждой точки выброса. Для очистки отходящих газов от вредных веществ с целью охраны природы для возвращения этих веществ в технологическую схему для более полного использования имеются газоочистные аппараты мокрой очистки, в которых при противоточном движении, газ снизу, жидкость сверху. Из газовой фазы в жидкостную переходит большая часть вредных веществ. Воздух содержащий минимум этих веществ выбрасывается в атмосферу. Орошающая жидкость, маточный раствор H3BO3 с to 20-25оС. На каждый м2 полезной поверхности контакта жидкости и газа нужно 2-5м3 жидкости, для увеличения контакта устанавливаются насадки. В качестве насадки используются полиэтиленовые кольца уложенные на решетках, закрепленные сетками в несколько слоев. Газоочисткой называется АПКН, орошающая жидкость возвращается на узел выщелачивания. Аппарат с подвижной кольцевой насадкой. Схема узла выщелачивания. Две линии: 241 → 281 → 282 → 283 → 284 → 1-11 242 → 285,6,7,8,9,10 → 321,2,3 Везде сжатый воздух, пар в позициях 28.7, 28.8, 28.9 в том числе острый пар в 28.9. Для выработки цеха (освобождение емкости от растворов) через стадию осаждения боратов кальция. Для разложения этих боратов (285) на узел выщелачивания подается H2SO4, в результате чего бораты разлагаются с образованием солей и борной кислоты. Отходящие газы от емкостей и от ленточных конвейеров, содержащие аэрозоли борной и серной кислот, воду и пыль поступают в АПКН для мокрой очистки. Контактируют с маточным раствором борной кислоты от позиции 65.3 и сливаются в позицию 28.10 или 28.4, очищенный газ вентилятором выбрасывается в атмосферу. Контроль процесса выщелачивания: to – 28.9, 28.10, 28.4 – автоматически; стеклянные термометры – to 60-65оС. Контроль плотности: мерный цилиндр с известным весом заполняем пульпой и взвешиваем. Масса емкости + пульпы – масса емкости = масса пульпы, делим на объем пульпы и получаем плотность. Расход исходных растворов: щелевые расходомеры. Проверка: очистить щель, пьезо-трубки, ящик, сливную трубу. рН: проба в химическую лабораторию. Концентрация В2О3 и других веществ: не менее 4р за смену. Концентромеры – приборы. Схема регулирования рН: смесь спека и бората с раствором борной кислоты насосом, позиция 12, нагнетается к емкостям позиции 28.1, 28.5 через пробковые краны, поворот стержня, которого изменяет количество смеси. Вращение клипа (стержня) осуществляется с помощью пневмосилового привода (ПСП). Шток ПСП рычагами соединен с пробкой (краном). Пневматический сигнал ПСП поступает от датчика рН-метра. Чем ниже рН, тем больше должен открываться кран, если рН высокий, кран должен быть закрыт. рН ниже 4.8 ед. избыток H2SO4, рН больше 5 ед. избыток бората. Причины невыдерживания рН: 1. Неправильно показывает рН-метр. 2. Не движется кран. 3. Износ пробкового крана (пропускает). 4. Нет подачи или большая подача от насоса, поз. 13. 5. Недостаток твердого в смеси. При падении рН ниже 4.5 ед. необходимо остановить супер камеру.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-28; просмотров: 105; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.188.11 (0.164 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
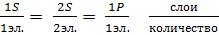
 Борная кислота Н3ВО3 – по внешнему виду это белые прозрачные пластинки в виде чешуек, шестигранные. Плотность 1,48 г/см3, растворяется в воде хорошо, с образованием ионов, т.е. заряженных частиц в малых количествах, это слабая кислота рН раствора – 4,8. В воде гидролизуется (соединяется с водой) с образованием Н2В4О7 – и другими полиметаллами ∙ В2О3 ∙ уН2О. для борной кислоты коэффициент диссоциации – это количество ионов водорода, умноженное на количество полиборной кислоты: константа диссоциации 6∙10-10. ОН
Борная кислота Н3ВО3 – по внешнему виду это белые прозрачные пластинки в виде чешуек, шестигранные. Плотность 1,48 г/см3, растворяется в воде хорошо, с образованием ионов, т.е. заряженных частиц в малых количествах, это слабая кислота рН раствора – 4,8. В воде гидролизуется (соединяется с водой) с образованием Н2В4О7 – и другими полиметаллами ∙ В2О3 ∙ уН2О. для борной кислоты коэффициент диссоциации – это количество ионов водорода, умноженное на количество полиборной кислоты: константа диссоциации 6∙10-10. ОН
 Н3ВО3 имеет строение НО – В
Н3ВО3 имеет строение НО – В


 О О
О О






 НО В В О В В ОН – тетраборная.
НО В В О В В ОН – тетраборная.


 Шкала рН рН = -lg [H3О+]
Шкала рН рН = -lg [H3О+]

 1 2 3 4 5 6 7 8 9 10 11 12 13 14
1 2 3 4 5 6 7 8 9 10 11 12 13 14


