
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение общей жёсткости воды
Общая жёсткость воды (Ж) определяется суммарным содержанием растворенных солей кальция и магния. Её принято выражать числом ммоль кальция и магния в 1 литре воды. Общая жесткость воды слагается из временной и постоянной жёсткости. Временная жёсткость обусловлена присутствием гидрокарбонатов кальция и магния, она устраняется кипячением воды. Под постоянной жёсткостью понимают содержание в Н2О других солей кальция и магния (сульфатов, хлоридов и др.). Её устраняют только химическим путём, например, добавлением карбоната или фосфата натрия. Природные воды по общей жёсткости подразделяются: на мягкие (Ж < 2 ммоль/л), средней жёсткости (Ж = 2-10 ммоль/л) и жёсткие (Ж > 10 ммоль/л). Для хозяйственно-питьевого водоснабжения пригодна вода с общей жёсткостью не более 7 ммоль/л. Методика эксперимента В работе следует определить общую жёсткость образца воды до кипячения и после кипячения. В термостойкую колбу наливают 250 мл образца воды и кипятят в течение 1 часа. В это время 50.00 мл исследуемой холодной воды с помощью пипетки Мора наливают в колбу для титрования, добавляют 5 мл аммонийного буфера (рН~ 9,5) и немного кристаллического эриохрома черного Т. Титруют раствором трилона Б с молярной концентрацией эквивалента С(1/2 Na2H2Y) равной 0.05000 моль/л до перехода окраски из винно-красной в синюю. В конце титрования раствор трилона Б прибавляют по каплям, тщательно перемешивая раствор. Общую жёсткость воды рассчитывают по формуле (в ммоль/л):
(3.18). Затем проводят определение общей жесткости образца воды после кипячения. Сравнивают результаты и делают выводы. Лабораторная работа Определение содержания цинка в растворе Лекарственные препараты на основе солей кальция (хлорида, глюконата, лактата), сульфатов цинка и магния широко используются в ветеринарии. Методика эксперимента В мерной колбе на 100.0 мл доводят объём исследуемого раствора соли цинка до метки дистиллированной водой и перемешивают. Пипеткой переносят 10.00 мл полученного раствора в колбу для титрования, добавляют 5-8 мл аммонийного буфера (рН~ 9,5), немного индикатора эриохрома черного Т и медленно титруют раствором трилона Б до перехода окраски из винно-красной в синюю.
На основе полученных экспериментальных данных рассчитывают массу катионов металла в растворе исследуемой соли.
3.5.3. Уровень требований по теме «Комплексонометрия» В результате изучения темы «Комплексонометрия» студент должен: знать: строение комплексных соединений (положения теории Вернера), сущность комплексонометрии, рабочие растворы и индикаторы метода; условия комплексонометрических определений; уметь: готовить стандартные и рабочие растворы, проводить стандартизацию рабочих растворов, собирать титровальную установку, правильно проводить титрование, проводить необходимые расчеты и математическую обработку полученных результатов; владеть: современной химической терминологией в области метода комплексонометрии; навыками работы с мерной посудой. 3.5.5. Контрольные задания 181-190 (комплексонометрия) 181. а) Какие вещества называются комплексонами? Что такое комплексон II и комплексон III? Напишите их условные формулы и структурную формулу ЭДТА. б) К раствору соли алюминия добавлено 25.00 мл раствора комплексона III, С (1/2 Na2H2Y) = 0.05000 моль/л, а на титрование избытка последнего затрачено 11.50 мл раствора MgSO4 , С (1/2 MgSO4) = 0.05000 моль/л. Вычислите массу алюминия в исходном растворе. 182. а) Какой метод титриметрического анализа называется комплексонометрией? Содержание каких веществ можно определять с помощью этого метода? Закончите уравнение образования хелата Al3+ c ЭДТА: Аl3+ + H2Y 2– = …… Чему равны факторы эквивалентности Al3+ и ЭДТА? б) На титрование 20.00 мл раствора MgSO4, титр которого 0.001205 г/мл, пошло 10.65 мл раствора трилона Б. Рассчитайте нормальную концентрацию и титр раствора трилона Б. 183. а) Как приготавливают рабочий раствор ЭДТА? Рассчитайте массу ЭДТА, необходимую для приготовления 250,0 мл его 0,5000 н раствора. б) Общая жесткость воды равна 6,25 ммоль/л. Какой объем раствора ЭДТА, С(1/2 ЭДТА) = 0.05000 моль/л расходуется на титрование 100.0 мл воды? 184. а) Приведите структурную формулу трилона Б, объясните на её основе кислотные и комплексообразующие свойства ЭДТА. Чему равен фактор эквивалентности трилона Б в комплексонометрии? Рассчитайте молярную массу эквивалента ЭДТА.
б) Минерал массой 0.1040 г, содержащий 99.25 % цинка, растворен в соляной кислоте. На титрование полученного раствора затрачено 18.20 см раствора ЭДТА. Рассчитать нормальную концентрацию раствора ЭДТА и его титр по цинку. 185. а) Взаимодействие между различными катионами металлов и ЭДТА. Напишите уравнения реакций. Закончите уравнение образования хелата Pb4+ c ЭДТА: Pb4+ + H2Y 2– = … Чему равны факторы эквивалентности Pb4+ и ЭДТА? б) На титрование 10.00 мл хлорида алюминия затрачено 20.45 мл раствора комплексона III, С(1/2 Na2H2Y) = 0.05125 моль/л. Найти массу соли алюминия в 200.0 мл раствора. 186. а) Кривые титрования в комплексонометрии. Какие факторы влияют на величину скачка на кривой титрования? Рассчитайте рСа в 0,1000 н растворе хлорида кальция. б) На титрование 10.00 мл никелевого электролита, содержащего NiSO4, расходуются при параллельных титрованиях следующие объемы 0.04595 н раствора трилона Б: 15.07 мл; 15.05 мл; 15.10 мл; 15.03 мл. Рассчитайте нормальную концентрацию и титр раствора NiSO4, а также массу этой соли в 500.0 мл электролита. 187. а) Какие индикаторы применяются в комплексонометрии? Охарактеризуйте эриохром черный Т. При каких условиях он может быть использован? б) В мерной колбе на 100.0 мл растворили 0.5100 г технического MnSO4. К 10.00 мл раствора прибавили 25.00 мл раствора трилона Б с молярной концентрацией эквивалента С(1/2 Na2H2Y) = 0.1000 моль/л. На титрование избытка его израсходовали 15.94 мл раствора ZnSO4, С(1/2 ZnSO4)=0.01049 моль/л. Вычислить массовую долю MnSO4 в образце. 188. а) Объясните сущность комплексонометрического титрования на примере катионов цинка. Запишите уравнения реакций с участием Zn2+. б) На титрование 0.0500 г препарата хлорида кальция, содержащего в качестве примесей NaCI и KCI, израсходовано 8.00 мл раствора трилона Б, нормальная концентрация которого равна 0.05000 моль/л. Рассчитайте массовую долю CaCI2 в анализируемом препарате. 189. а) Что такое общая жесткость воды, в каких единицах она выражается? Какие методы устранения жесткости воды вам известны? Подтвердите соответствующими уравнениями реакций. По какой формуле рассчитывается общая жесткость воды? Как найти временную жесткость, если известны общая и постоянная жесткость воды? б) Рассчитайте массовую долю цинка в руде, если на титрование раствора, приготовленного из ее навески 0.9003 г, затрачено 19.51 мл раствора трилона Б, нормальная концентрация которого равна 0.04575 моль/л. 190. а) Напишите структурную формулу хелата Са2+ с трилоном Б. Определите дентантность лиганда. Закончите уравнение образования хелата Са2+ c ЭДТА: Са2+ + H2Y 2– = ……. Запишите формулу для расчета константы устойчивости образующегося хелата. б). Сточные воды содержат соли железа (III). Вычислите титр и нормальную концентрацию железа (III) в сточной воде, если на титрование ее 25.00 мл идет 5.05 мл раствора ЭДТА, нормальная концентрация которого равна 0.05150 моль/л.
Гравиметрический анализ Теоретические основы метода Гравиметрический анализ – это метод количественного анализа, основанный на точном измерении массы вещества известного состава, химически связанного с определяемым компонентом. Аналитическим сигналом в гравиметрическом анализе служит масса вещества. Основным прибором являются аналитические весы.
Достоинства метода: - универсальность, он пригоден для определения большинства известных неорганических катионов и анионов; неорганических (Н2O, Н2S, СO2, I2 ) и органических соединений (лактоза в молочных продуктах, салицилаты в лекарственных препаратах, никотин в ядохимикатах и т.д.); - он является одним из самых точных методов анализа, его погрешность не превышает 0.1- 0.2%; - метод не требует сложной аппаратуры. Недостатком метода является длительность анализа (от 2 до 24 часов). Например, анализ на сульфат ион SO42- длится 10-15 часов). Гравиметрический анализ выполняется двумя методами – методом отгонки и методом осаждения. Метод отгонки – предназначен для определения содержания летучих компонентов (Н2O, SO2 , СO2 и др.). Широко используется для контроля влажности почвы, удобрений, пищевых продуктов, кормов, медицинских препаратов и др. Под влажностью понимают массовую долю гигроскопической, т.е. адсорбированной воды в образце. Рассчитывают её по формуле: ω (Н2O) = В методе отгонки определяемый компонент выделяется из пробы в виде газа при нагревании. Анализ основан либо на определении массы отогнанного вещества, либо на определении массы остатка. Метод осаждения - в нем определяемый компонент с помощью химической реакции переводят в осадок, который представляет собой малорастворимое сложное или простое вещество (углерод, металл – Ag, Au, Pt, др.). После фильтрования, промывания, высушивания и прокаливания, осадок известного состава взвешивают и по его массе рассчитывают содержание определяемого компонента в образце. С помощью данного метода определяют, например, содержание фосфора в фосфорных удобрениях, почвах, кормах; содержание магния и кальция в известняках, доломитах и силикатах. Например, определение Mg2+ основано на следующих реакциях: Mg2+ + HPO42- + NH4OH → MgNH4PO4↓ + H2O 2MgNH4PO4↓ → Mg2P2O7↓ + 2NH3↑ + H2O Первоначально катион магния осаждается в виде осадка магний-аммоний фосфат MgNH4PO4, который называется осаждаемой формой. Затем, после прокаливания при температурах 800-1000◦С, образуется пирофосфат магния Mg2P2O7, который называется гравиметрической формой. Состав её должен точно соответствовать приведенной химической формуле. В ряде случаев эти обе формы могут совпадать, например, при осаждении катиона серебра Ag+ в виде AgCl или Ba2+ в виде BaSO4.
Для расчетов массы определяемого компонента удобно пользоваться понятием гравиметрического фактора (F) или фактора пересчета. Он равен отношению молярной массы определяемого вещества (компонента) к молярной массе вещества, находящегося в прокаленном осадке (гравиметрическая форма) с учетом коэффициентов в химической реакции. Пусть: А – определяемый компонент; В – гравиметрическая форма осадка; а и в – стехиометрические коэффициенты в уравнении реакции. аА → осаждаемая форма → в В (гравиметрическая форма) Тогда: F = Масса определяемого компонента (вещества) равна произведению гравиметрического фактора на массу осадка В: m(А) = F ∙ m(В) (3.21). Гравиметрический фактор F показывает, сколько граммов определяемого вещества содержит 1 г гравиметрической формы осадка. Для вычисления массовой доли определяемого компонента в исследуемом образце используют формулу: ω (%) = F ∙
где m (образца) – масса исследуемого образца. Значения гравиметрического фактора F приведены в разделе «Приложения» в таблице 6. Примеры решения задач по теме «Гравиметрический анализ» Пример 1. Вычислите факторы пересчета для следующих веществ: Вещество Ca Cl S Cr Fe2O3 MgSO4 Гравиметрическая CaO AgCl BaSO4 Cr2O3 FePO4 Mg2P2O7 форма Решение: Для каждого вещества используем формулу (3.20): F1 = M (Ca) / M (CaO) = 40.08 / 56.08 = 0.7147 F2 = M (Cl) / M (AgCl) = 35.453 / 143.32 = 0.2474 F3 = M (S) / M (BaSO4) = 32.064 / 233.40 = 0.1374 F4 = 2 M (Cr) / M (Cr2 O3) = (2×51.996) / 151.99 = 0.6842 F5 = M (Fe2 O3) / 2 M (Fe PO4) = 159.69 / (2×150.82) = 0.5294 F6 = 2 M (Mg SO4) / M (Mg2 P2O7) = (2×120.37) / 222.57 = 1.0816
Пример 2. После соответствующей обработки 0.9000 г сульфата калия-алюминия получен осадок Al2O3 массой 0.0967 г. Вычислите массовую долю (%) алюминия в исследуемом образце. Решение: Формула сульфата калия-алюминия KAl(SO4)2 ∙ 12 H2O. Определяемый компонент - Al; гравиметрическая форма - Al2O3 . В этом случае гравиметрический фактор с учетом стехиометрических коэффициентов рассчитываем по формуле F = 2 M(Al) / M (Al 2 O3) = (2×26.981) / 101.96 = 0.5292 Для вычисления содержания алюминия используем формулу (3.22): ω (%) = F ∙ w (Al), % = (0.5292 ∙ 0.0967 / 0.9000) ∙ 100% = 5.69% Ответ: Массовая доля алюминия в исследуемом образце w (Al) = 5.69%. Пример 3. Какую навеску сульфата железа FeSO4 ∙ 7 H2O следует взять для определения в нем железа в виде Fe2O3, считая массу осадка (Fe2O3) равной 0.2000 г? Решение: Определяемый компонент (вещество) - FeSO4 ∙ 7 H2O; гравиметрическая форма - Fe2O3 . В данном случае фактор пересчета с учетом стехиометрических коэффициентов рассчитываем по формуле: F = 2 М (Fe SO4 ∙ 7 H2O) / M (Fe 2O3) = (2×278.02)/159.69 = 3.4820. Тогда навеску FeSO4 ∙ 7 H2O рассчитываем по формуле:
m (FeSO4 ∙ 7 H2O) = F ∙ m (Fe2O3) = 3.4820 ∙ 0.2000 = 0.6964 г. Ответ: m (FeSO4 ∙ 7 H2O) = 0.6964 г. 3.6.2. Контрольные задания 191-200 (гравиметрический анализ) 191. а)Охарактеризуйте методы отгонки и осаждения. б) В растворе, содержащем ионы хлора, хлор осажден в виде AgCl, масса которого после высушивания и прокаливания оказалась равной 0.1562 г. Написать уравнение реакции и вычислить массу хлора в растворе. 192. а) Что такое гравиметрический анализ? Его достоинства и недостатки. Для определения содержания каких веществ применяется? б) Для определения сульфатной серы в минерале его навеску в 1.1850 г перевели в раствор, а сульфат - ионы осадили в виде BaSO4. Осадок промыли, высушили и прокалили. Масса BaSO4 составила 0.1321 г. Вычислить массу и массовую долю (%) серы в навеске. 193. а) Что представляют собой осаждаемая и гравиметрическая формы? Рассмотрите на примере определения катионов магния. Напишите уравнения реакций и рассчитайте гравиметрический фактор. б) Вычислите массовую долю (%) гигроскопической воды в хлориде натрия по следующим данным: масса бюкса 0.1282 г; масса бюкса с навеской 6.7698 г; масса бюкса с навеской после высушивания 6.7506 г. 194. а)Перечислите химическую посуду и приборы, необходимые для проведения метода осаждения в гравиметрическом анализе. б)Из навески серебряного сплава 0.2466 г, после соответствующей обработки, был получен осадок хлорида серебра массой 0.2675 г. Вычислить массовую долю (%) серебра в сплаве. 195. а)Перечислите правила взвешивания на аналитических весах. б) В растворе хлорида магния осадили магний в виде MgNH4PO4. После прокаливания масса полученного осадка Mg2P2O7 была равна 0.1113 г. Написать уравнения реакций и вычислить массу магния в растворе. 196. а)Опишите операцию фильтрования осадков. Как правильно выбрать фильтр для того или иного случая фильтрования? б) Вычислить навеску карбоната кальция, необходимую для получения осадка (гравиметрической формы) CaO массой 0.3000 г. 197. а) Как проводятся вычисления результатов анализа в методе осаждения? б) В растворе сульфата железа (III) железо было осаждено в виде гидроксида. Масса прокаленного осадка Fe2O3 оказалось равной 0.3288 г. Вычислить массу железа в растворе. 198. а) Что представляют собой осаждаемая и гравиметрическая формы? Рассмотрите на примере определения катионов серебра. Напишите уравнения реакций и рассчитайте гравиметрический фактор. б)Для анализа взято 0.4328 г фосфорного удобрения. Масса прокаленного осадка пирофосфата магния Mg2P2O7 составила 0.1823 г. Вычислить массовую долю фосфора (Р) в удобрении. 199. а)Опишите операции гравиметрического анализа – высушивание и прокаливание осадков. б)Масса прокаленного осадка BaSO4 составила 0.4128 г. Чему равна масса химически чистого FeS, из которой получен осадок BaSO4? 200. а)Что называется гравиметрическим фактором? Как он рассчитывается и какую роль играет в методе осаждения? б) Вычислите массовую долю (%) гигроскопической воды в иодиде калия по следующим данным: масса тигля 4.4523 г; масса тигля с веществом 9.9727 г; масса бюкса с веществом после высушивания 9.9512 г. ЛИТЕРАТУРА 1. Князев, Д.А. Неорганическая химия. / Д.А. Князев, С.Н. Смарыгин. М.: Юрайт, 2012. 598 с. 2. Хомченко, Г.П. Неорганическая химия. / Г.П. Хомченко, И.К. Цитович. СПБ: ИТК ГРАНИТ, 2009. 464 с. 3. Глинка, Н.Л. Общая химия: учебное пособие для вузов. / Н.Л. Глинка. М.: Интеграл-Пресс, 2010. 728 с. 4. Лидин, Р.А. Химические свойства неорганических веществ. / Р.А. Лидин, В.А. Молочко, Л.А. Андреева. М.: Колосс, 2008. 480с. 5. Литвинова, Т.Н. Сборник задач по общей химии. / Т.Н. Литвинова. М.: Оникс. Мир и образование, 2007. 223 с. 6. Хомченко, И.Г. Общая химия. / И.Г. Хомченко. М.: Новая волна, 2011. 464 с. 7. Глинка, Н.Л. Задачи и упражнения по общей химии. / Н.Л. Глинка. М.: Интеграл-Пресс, 2009. 240 с. 8. Цитович, И.К. Курс аналитической химии. / И.К. Цитович. М.: Лань, 2009. 495 с. 9. Власова, Е.Г. Аналитическая химия: химические методы анализа./ Е.Г. Власова; под ред. О.М. Петрухина, Л.Б. Кузнецовой. М.: Лаборатория знаний, 2017. 464 с. 10. Золотов, Ю.А. Введение в аналитическую химию. / Ю.А. Золотов. М.: Лаборатория знаний, 2016. 263 с. 11. Моногарова, О.В. Аналитическая химия. Задачи и вопросы. Учебное пособие. / О.В. Моногарова, С.В. Мугинова, Д.Г. Филатова; под ред. Т.Н. Шеховцовой. М.: ГЕОТАР-Медиа, 2016. 112 с. 12. Волков, А.И. Справочник по аналитической химии. / А.И. Волков, И.М. Жарский. Минск. ООО «Литера Гранд», 2014. 320 с. 13. Хаханина, Т.И. Аналитическая химия. / Т.И. Хаханина, Н.Г. Никитина. М.: Издательство Юрайт, 2016. 278 с.
ПРИЛОЖЕНИЯ Таблица 1 Плотность (ρ) и концентрация (ω) водных растворов некоторых веществ (20º С)
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

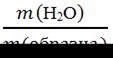 ∙100% (3.19).
∙100% (3.19).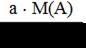 (3.20).
(3.20).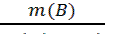 ∙100% (3.22);
∙100% (3.22);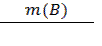 ∙100%
∙100%


