
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Стандартизация раствора кислоты титрованием
Для проведения титрования собирают титровальную установку. Она состоит из следующих частей: 1) штатива, в лапке которого закреплена бюретка; 2) конической колбы для титрования; 3) пипетки для отбора аликвоты исследуемого раствора «грушей»; 4) белого экрана на основании штатива; 5) воронки для заполнения бюретки. Бюретку емкостью 25.00 мл укрепляют в штативе. Сначала ее ополаскивают 10 – 15 мл раствора кислоты, затем бюретку заполняют раствором кислоты выше уровня нулевого деления. Во время работы следят за тем, чтобы носик бюретки был заполнен раствором кислоты. Лишь перед самым началом титрования устанавливают уровень кислоты на нулевое деление, осторожно сливая избыток кислоты из бюретки в стакан. Пипеткой Мора отбирают 10.00 мл раствора тетрабората натрия, для этого оттянутый конец пипетки опускают в бутыль почти до дна и засасывают раствор выше метки с помощью резиновой груши. Затем закрывают верхнее отверстие пипетки указательным пальцем и вынимают ее из колбы. Аликвота раствора выливается в коническую колбу для титрования, куда вносят 1-2 капли индикатора метилоранжа. Колбу подставляют под носик бюретки, который во время титрования должен быть на 1-2 см опущен в горло колбы. По мере вытекания раствора из бюретки содержимое колбы непрерывно перемешивают плавными круговыми движениями. Титрование заканчивается, когда от добавленной очередной капли кислоты происходит изменение окраски раствора тетрабората натрия из желтой в розовую. Титруют до получения трёх сходящихся результатов. После окончания каждого титрования отсчитывают по шкале бюретки объем кислоты, израсходованной на титрование, и снова заполняют бюретку раствором кислоты до нулевого деления. Результаты титрования записывают в виде таблицы:
Затем проводят расчет молярной концентрации эквивалента и титра кислоты по среднему значению объема кислоты. Лабораторная работа Определение содержания щелочи в растворе Целью работы является определение массы щелочи (NаОН) в растворе. Студент получает у преподавателя мерную колбу на 100.0 мл, в которую налито определенное количество щелочи. До риски в колбу добавляют дистиллированную воду, раствор тщательно перемешивается. В бюретку наливают кислоту, стандартизированную в предыдущей лабораторной работе. В коническую колбу для титрования отбирают пипеткой Мора 10.00 мл NаОН, прибавляют 1-2 капли индикатора метилоранжа и титруют раствором кислоты до появления оранжево-розовой окраски. Титруют до получения трёх сходимых результатов. Результаты записывают в таблицу, аналогичную в предыдущей работе. Рассчитывают нормальную концентрацию и титр щелочи, а также массу NаОН в 100.0 мл анализируемого раствора по вышеприведенным формулам (раздел 3.1).
Лабораторная работа Определение кислотности квашеных овощей При квашении овощей происходит молочнокислое брожение, в результате которого образуется молочная кислота Определение кислотности квашеных овощей сводится к титрованию их рассолов щелочью. Выражают кислотность в процентах молочной кислоты, которые показывают, сколько г молочной кислоты содержится в 100 г рассола. Например, реализуемая квашеная капуста должна иметь кислотность в зависимости от времени хранения от 0.7 до 2.4% Методика эксперимента В колбу для титрования наливают пипеткой 10.00 мл рассола, 3-5 капель фенолфталеина и оттитровывают раствором щелочи до появления устойчивой розовой окраски. Расчет кислотности рассола проводят по формуле: где Х – кислотность рассола в % молочной кислоты; V(NaOH) – объем щелочи, пошедшей на титрование аликвоты рассола (мл), пересчитанный на концентрацию С (NaOH) = 0.1000 моль/л, по формуле V(NaOH) = С (NaOH)практ ∙ V(NaOH)практ / 0.1000; K – коэффициент пересчета на молочную кислоту, равный 0.00900; Vраствора – объем рассола, взятый для титрования (мл).
3.3.5. Уровень требований по теме
«Метод нейтрализации» В результате изучения темы «Метод нейтрализации» студент должен: знать: сущность метода нейтрализации, типы кривых титрования, понятие о точке эквивалентности, теорию кислотно-основных индикаторов, правила выбора индикаторов кислотно-основного титрования; уметь: готовить первичные и вторичные стандартные растворы, проводить стандартизацию растворов, собирать титровальную установку, правильно проводить титрование; рассчитывать нормальную концентрацию анализируемого раствора и его титр двумя способами; владеть: современной химической терминологией в области метода нейтрализации, навыками работы с мерной посудой. 3.3.6. Контрольные задания 161-170 (метод нейтрализации) 161. а) Какой метод титриметрического анализа называется методом нейтрализации? Содержание каких веществ можно определять с помощью этого метода? Рассчитайте молярные массы эквивалента: H3PO4 в реакции H3PO4 + 2NaOH = Na2HPO4 + 2H2O и Na2СО3 в реакции Na2СО3 + HCl = NaHСО3 + NaCl. б) Проведена стандартизация раствора соляной кислоты. Для этого 5. 2060 г безводной соды Na2CO3 растворены в мерной колбе на 500.0 мл. Объём аликвоты раствора соды 25.00 мл, средний объём раствора кислоты по бюретке 26.18 мл. Рассчитать С(HCl), T(HCl), T(HCl/ Na2CO3). 162. а)Кривые титрования в методе нейтрализации и их типы. В общем виде изобразите их. б) Навеску 0.3251 г технического NaOH растворили в мерной колбе ёмкостью 100.0 мл. На титрование 25.00 мл раствора израсходовано 18.40 мл 0.1000 н раствора HCl. Вычислите массовую долю NaOH в образце. 163. а) Какое практическое значение имеют кривые кислотно-основного титрования? Что такое скачок титрования? От чего зависит величина скачка титрования? В какой области рН лежит точка эквивалентности при титровании раствора слабого основания сильной кислотой? б) Сколько мл раствора KOH с титром 0.01111 г/мл требуется для нейтрализации 25.00 мл раствора HCl с титром 0.007777 г/мл? 164. а) Что такое точка эквивалентности? Каким способом её фиксируют в методе нейтрализации? В какой области рН лежит точка эквивалентности при титровании раствора слабой кислоты сильным основанием? б) На титрование 25.00 мл раствора Вa(OH)2 затрачено 23.61 мл раствора соляной кислоты с титром 0.004023 г/мл. Вычислить массу щелочи в 200.0 мл этого раствора. 165. а) Какие вещества называются кислотно-основными индикаторами? Константа диссоциации индикатора бромтимолового синего 1.6 · 10 –7. Рассчитать интервал перехода его окраски и показатель титрования. б) Сколько миллиграммов Na2CO3 содержится в растворе, если на нейтрализацию его до Н2CO3 идёт 23.00 мл 0.1025 н раствора HCl? 166. а) Правила выбора кислотно–основных индикаторов. Скачок титрования лежит в интервале от рН=5 до рН= 9. Какие индикаторы можно выбрать для фиксирования точки эквивалентности, используя таблицу 7 в разделе «Приложения»? б) В агрохимическую лабораторию поступила склянка со щелочью со стёртой этикеткой. Титрование 1.100 г этого вещества потребовало 31.10 мл 0.8600 н раствора HCl. Какая щелочь КОН или NaOH была в склянке? 167. а)Бюретки. Основные правила работы с ними. Какова точность отсчётов по бюретке? В лабораторном журнале агрохимика представлены следующие замеры объёма кислоты по бюретке: 23.0 см3; 23 см3; 23.00 см3. Какая запись правильная? Почему? б)Для определения точной концентрации раствора КОН навеску 2.3500 г щавелевой кислоты H2C2O4 растворили в колбе на 200.0 мл. На титрование 20.00 мл этого раствора затрачено 19.36 мл раствора КОН. Вычислите нормальную концентрацию и титр раствора щелочи.
168. а)Какие способы выражения концентрации растворов используются в титриметрическом анализе? Что означает T(HCl/ Na2CO3) = 0.001525 г/мл? б)Точную навеску буры Na2B4O7∙10 H2O массой 0.8714 г растворили в мерной колбе объемом 250.0 мл. На титрование 10.00 мл полученного раствора пошло 10.55 мл, 10.50 мл и 10.60 мл раствора азотной кислоты. Рассчитайте титр и молярную концентрацию эквивалента HNO3 в растворе. 169. а)Дайте определение понятий: титриметрический анализ, аналитический сигнал, титрование, стандартный раствор, первичные стандарты и требования к ним. Что служит аналитическим сигналом и первичным стандартом в методе нейтрализации? б) Вычислить массу молочной кислоты CH3CH(OH)COOH в 400.0 мл раствора, если на 10.00 мл этого раствора израсходовано 12.50 мл раствора гидроксида натрия, Т(NaOH) = 0.001950 г/мл. 170. а)Какие методы различают в титриметрическом анализе в зависимости от типа химической реакции? Какие способы (приёмы) титрования применяются в этих методах? В чем сущность обратного титрования? б)Какую массовую долю (%) карбоната натрия Na2CO3 содержит образец загрязненной соды, если на полную нейтрализацию 0.2648 г соды израсходовано 24.45 мл 0.1970 н раствора HCl?
|
|||||||||||||||
|
Последнее изменение этой страницы: 2020-11-22; просмотров: 296; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.135.224 (0.016 с.) |
 . Она является консервантом и обеспечивает длительную сохранность овощей, а также придает им специфический кислый вкус.
. Она является консервантом и обеспечивает длительную сохранность овощей, а также придает им специфический кислый вкус.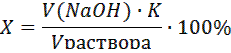 (3.17);
(3.17);


