Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчеты в титриметрическом анализе
Титриметрический анализ – это метод количественного анализа, основанный на определении объема раствора реагента с точно известной концентрацией, затраченного на реакцию с определяемым компонентом. В основе титриметрического анализа лежит химическая реакция: bB + a A = продукты B – определяемое или титруемое вещество (компонент), концентрация его не известна; A - рабочий раствор или титрант, его концентрация известна; a и b – стехиометрические коэффициенты реакции. Любой раствор с точно известной концентрацией называется стандартным раствором. По способу приготовления стандартные растворы делятся на первичные и вторичные. Первичный стандартный раствор можно приготовить двумя способами: 1) Растворением точной навески вещества в определенном объеме растворителя. Вещества, по навеске которых можно приготовить стандартный раствор, называются первичными стандартами (установочные вещества, исходные вещества). Их состав должен строго соответствовать химической формуле, они должны быть химически чистыми и устойчивыми при хранении в твердом виде и в растворе. Каждый метод титриметрического анализа имеет свой первичный стандарт. 2) По фиксаналам или стандарт-титрам. Это промышленным способом приготовленные и запаянные в стеклянные ампулы точные навески веществ или объемы жидкостей, растворением которых в определенном объеме воды можно приготовить раствор с точно известной концентрацией. Вторичный стандартный раствор готовят по приблизительной навеске с приблизительной концентрацией, затем определяют его концентрацию, т.е. стандартизируют по подходящему первичному стандартному раствору. Основной операцией в титриметрическом анализе является титрование - это процесс постепенного прибавления титранта к раствору определяемого вещества до тех пор, пока их количества не станут эквивалентными. Этот момент называется точкой эквивалентности (ТЭ), которая фиксируется обычно по изменению окраски индикатора или другим способом. В зависимости от типа реакции в титриметрическом анализе различают: 1) метод кислотно-основного титрования (метод нейтрализации, протолитометрия); 2) метод окислительно-восстановительного титрования (редоксметрия);
3) метод комплексонометрического титрования (комплексонометрия); 4) метод осадительного титрования. В любом из этих методов можно использовать разные приемы (способы) титрования: 1) Прямое титрование – самое распространенное и удобное. Используется один рабочий раствор (титрант). Окончание титрования устанавливают по изменению окраски индикатора. По шкале бюретки определяют объем титранта, пошедший на реакцию (это аналитический сигнал), и по нему находят содержание определяемого вещества. Все расчеты ведут на основе закона эквивалентов: вещества взаимодействуют между собой и образуются в равных количествах эквивалентов. Для реакции b B + a A = d D + c C запись этого закона имеет вид: 𝛎(1/zB) = 𝛎(1/zA)= 𝛎(1/zD)= 𝛎(1/zC) (3.1); где 𝛎(1/zX)- число молей эквивалентов любого из участвующих в реакции веществ (Х); B – определяемое вещество; A - рабочий раствор. Из этого уравнения вытекают следующие расчетные формулы: c ( Уравнение (3.3) называют основным уравнением титриметрического анализа. Комбинированием уравнений 3.2 и 3.3 получают формулы: m(B) = c ( При титровании методом пипетирования массу определяемого компонента рассчитывают по формуле: m(B) = В приведенных выше уравнениях (3.2 - 3.7) использованы следующие обозначения: c (1/z X) – молярная концентрация эквивалента вещества (X) или нормальная концентрация, моль/л; m(X) – масса вещества, г; M(1/z X) – молярная масса эквивалента вещества, г/моль; 1/z – фактор эквивалентности; V(X) – объем раствора, в уравнениях (3.4-3.6) выражается в литрах; в уравнениях (3.3 и 3.7) объемы V(Х), V(колбы), V(аликвоты) выражаются в мл или см3. При проведении расчетов в аналитической химии удобно пользоваться понятиями титра и титра рабочего раствора по определяемому веществу.
Титр раствора вещества – Т(X), г/см3 или г/мл - показывает, сколько граммов растворенного вещества содержится в 1 см3 (мл) раствора. Т(X) = Между нормальной концентрацией и титром существует взаимосвязь: c( Титр рабочего раствора по определяемому веществу - Т раб/опр или Т А/В - показывает, сколько г определяемого вещества взаимодействует с 1 мл (см3) рабочего раствора. Траб/опр = Эту величину можно рассчитать по формулам: Траб/опр =
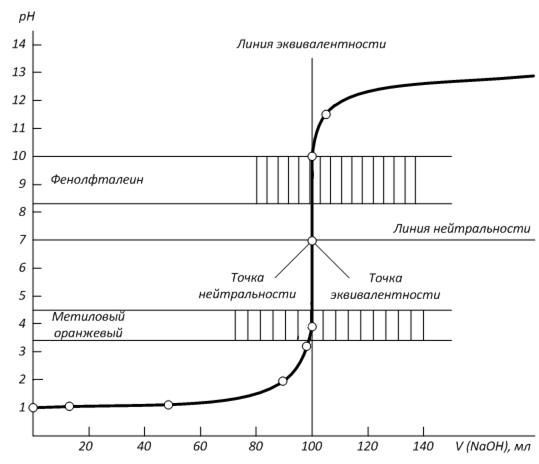
Траб/опр Расчеты титра, нормальной концентрации и массы определяемого вещества при обработке экспериментальных данных проводят двумя способами: I способ (по основному уравнению титриметрического анализа): 1) c ( 2) Т(В) = 3) m(В) = Т(В) ∙ V(колбы) II способ (через титр рабочего раствора по определяемому веществу): 1) Траб/опр = 2) Т (В) = 3) c ( 4) m(В) = Т(В) ∙ V(колбы). Здесь: В - определяемое вещество, А-рабочий раствор, V(колбы) - объем мерной колбы. Наряду с прямым титрованием (1), описанном выше, в титриметрическом анализе используются и другие способы (приёмы) титрования. 2) Обратное титрование - используют, когда прямое титрование невозможно или когда определяемое вещество неустойчиво. В данном способе титрования к определяемому веществу добавляют в избытке определенный объем (V1) рабочего раствора №1. Затем его избыток оттитровывают рабочим раствором №2 (V2). Расчет содержания определяемого вещества ведут с учетом двух химических реакций, используя V1 и V2. 3) Заместительное титрование – применяют, когда нет подходящей реакции или индикатора для прямого титрования. В данном способе титрования к определяемому веществу добавляют вспомогательный реагент. Получившийся в эквивалентном количестве продукт, оттитровывают подходящим титрантом. По объему титранта сразу рассчитывают содержание определяемого вещества, минуя все расчеты вспомогательных реагентов. 4) Реверсивное титрование – применяют, когда определяемое вещество неустойчиво в условиях эксперимента. В этом случае рабочий раствор титруют раствором определяемого вещества. Способ используют, например, для определения содержания нитритов методом перманганатометрии. Метод нейтрализации Применяется для определения содержания кислот, оснований, солей, подвергающихся гидролизу и других веществ, реагирующих с кислотами или основаниями. В основе этого метода лежит реакция: H+ + OH- = H2O или H3O+ + OH- = 2 H2O Кривые титрования в методе нейтрализации - это графическая зависимость pH раствора от объема добавленного титранта. Рассмотрим три случая кривых титрования. 1) Титрование сильной кислоты сильным основанием (рис.1.): HCl + NaOH = NaCl + H2O Расчет кривой проведен для титрования 100.0 мл 0.1000 н раствора HCl 0.1000 н раствором NaOH. На кривой титрования наблюдается скачок титрования - это резкое изменение pH раствора вблизи точки эквивалентности. В данном случае скачок титрования лежит в интервале от рН=4 до рН=10. Величина скачка составляет 6 единиц рН.
Точка эквивалентности (ТЭ) совпадает с точкой нейтральности (ТН) – это точка, в которой рН раствора равен 7. Кривая титрования симметрична относительно точки эквивалентности и точки нейтральности. 2) Титрование слабой кислоты сильным основанием (рис.2.): CH3COOH + NaOH = CH3COONa + H2O Расчет кривой проведен для случая взаимодействия 100.0 мл 0.1000 н раствора CH3COOH с 0.1000 н раствором NaOH. В данном случае скачок титрования лежит в интервале от рН=7.76 до рН=10. Величина скачка составляет 2.24 единиц pH, что значительно меньше, чем в первом случае. Точка эквивалентности лежит в щелочной области (pH = 8.87) и не совпадает с точкой нейтральности в результате гидролиза соли CH3COONa по аниону. Кривая титрования несимметрична относительно ТЭ и ТН.
Рис. 1. Титрование сильной кислоты сильным основанием.
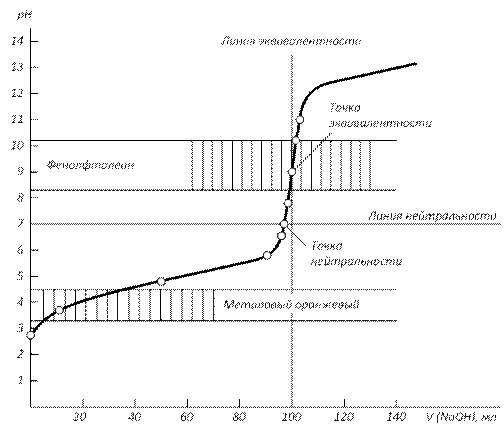
Рис.
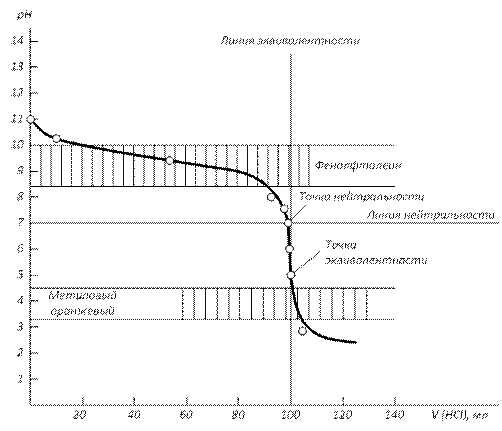
3) Титрование слабого основания сильной кислотой (рис.3.):
NH4OH + HCl = NH4Cl + H2O Расчет кривой проведен для взаимодействия 100.0 мл 0.1000 н раствора NH4OH с 0.1000 н раствором HCl. В данном случае скачок титрования находится в интервале от рН=4 до рН=6,24. Величина скачка составляет 2.24 единиц pH. Точка эквивалентности лежит в кислотной области (pH=5.11) и не совпадает с точкой нейтральности в результате гидролиза соли NH4Cl по катиону. Кривая титрования несимметрична относительно ТЭ и ТН.
Во всех трех случаях величина скачка увеличивается с увеличением концентрации реагирующих веществ и с уменьшением температуры. Чем больше величина скачка рН, тем точнее можно оттитровать определяемое вещество.
|
|||||||||||||
|
Последнее изменение этой страницы: 2020-11-22; просмотров: 198; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.220.120 (0.026 с.) |
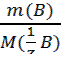 =
= 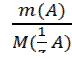 (3.2);
(3.2); ) ∙ V(B) = c (
) ∙ V(B) = c (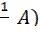 ∙ V(A) (3.3);
∙ V(A) (3.3);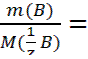 c (
c (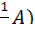 ∙ V(A) (3.4);
∙ V(A) (3.4);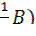 ∙ V(B) (3.5);
∙ V(B) (3.5);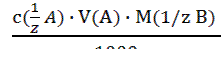 ∙
∙ 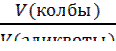 (3.7).
(3.7). (3.8).
(3.8). x) =
x) = 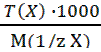 (3.9); Т(X) =
(3.9); Т(X) = 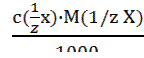 (3.10).
(3.10).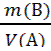 (3.11).
(3.11).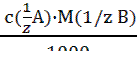 (3.12); Траб/опр =
(3.12); Траб/опр = 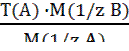 (3.13);
(3.13);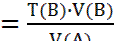 (3.14).
(3.14).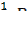 ) ∙ V(B) = c (
) ∙ V(B) = c (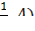 ∙ V(A);
∙ V(A);  ;
;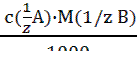 ;
;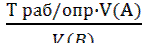 ;
; B) =
B) = 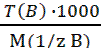 ;
;