
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт № 1. Приготовление буферных растворов
Приготовьте по 4 мл буферных растворов: ацетатного: (2 млраствора СН3СООН с концентрацией С(СН3СООН)=0.1 моль/л + 2 мл раствора CH3COONa с концентрацией С(CH3COONa)=0.1 моль/л) аммонийного:
Определите экспериментально рН обеих буферных смесей и сравните с расчетными значениями. Опыт № 2. Буферное действие В две пробирки налить по 1 мл ацетатного и аммиачного буферов порознь. В первый буфер внести 1 каплю 0.05 моль/л соляной кислоты, во вторую - 1 каплю 0.05 моль/л раствора гидроксида натрия. Растворы перемешать стеклянной палочкой.
2. Изменился ли рН растворов? 3. Объясните механизм буферного действия. Опыт № 3. Влияние разбавления на рН буферного раствора Поместите в пробирку 5 капель приготовленного ацетатного буфера и разбавьте его в 25 раз (добавьте 6 мл воды). Затем разбавьте смесь еще в 10 раз.
2. Используя формулы для расчета рН буферных смесей, объясните полученные результаты. Опыт № 4. Потеря буферного действия Налейте в 4 пробирки по 0.5 мл приготовленного ацетатного буферного раствора, затем добавить раствора гидроксида натрия С(NaOH) = 0.05 моль/л: в первую - 1 каплю, во вторую - 2 капли, в третью - 3 капли, в четвертую - 4 капли.
2. Постройте график в координатах: рН буферного раствора – объем щелочи (объем капли принять равным 0.05 мл). 3. Что такое буферная емкость? 4. Как рассчитывается буферная емкость? 5. При каком объеме (концентрации) кислоты прекращается действие приготовленного буфера? Гидролиз солей Гидролизом солей называется обменная реакция ионов соли с молекулами воды, в результате которой смещается равновесие диссоциации воды и часто изменяется рН растворов. Согласно современным представлениям о механизме диссоциации. ионы в водном растворе окружены гидратной оболочкой. Катионы удерживают свою гидратную оболочку за счет донорно-акцепторной связи:
Katz+ ← О
Анионы удерживают свою гидратную оболочку за счет водородной связи:
Н
Таким образом, гидролиз является результатом поляризационного взаимодействия ионов соли с их гидратной оболочкой. Гидролизу подвергаются соли, образованные: 1. слабым основанием и сильной кислотой; 2. сильным основанием и слабой кислотой; 3. слабой кислотой и слабым основанием; Соли, образованные сильной кислотой и сильным основанием и нерастворимые соли гидролизу не подвергаются. I. Гидролиз по катиону (соль образована слабым основаниями и сильной кислотой). Под действием электрического поля иона соли в молекуле воды происходит перераспределение зарядов, и молекула воды становится более полярной, связи в ней разрываются. Этот процесс для катионов можно представить так:
Н
Существуют соли: а) однозарядных катионов NH4+, Cu+; б) двухзарядных Си2+, Zn2+, Cd2+, Mn2+; в) трехзарядных А13+, Cr3+, Fe3+. Пример: Рассмотрим гидролиз соли хлорида цинка. Так как катион Zn2+ двухзарядный, гидролиз идет ступенчато. По второй ступени гидролиз идет незначительно. 1ступень: Ионное уравнение: Zn2+ + Н2О <=> ZnOH+ + Н+ Молекулярное уравнение: ZnCl2 + Н2О <=> ZnOHCl + HC1 2ступень: ZnOH+ + Н2О <=> Zn(OH)2 + Н+ ZnOHCl + Н2О <=> Zn(OH)2 + HCl Ионное уравнение показывает: а) гидролизу подвергаются катионы Zn2+; б) в результате реакции гидролиза накапливаются ионы Н+, которые сообщают среде кислую реакцию (рН<7). II. Гидролиз по аниону (соли образованы сильными основаниями и слабыми кислотами). Взаимодействие анионов с гидратной оболочкой можно выразить схемой
Н Существуют соли: а) однозарядных анионов CN ¯, СlO ¯; б) двухзарядных анионов S2-, SO32-, СО3 2-; б) трехзарядных анионов ВО33-, СrО33-. Пример: Рассмотрим гидролиз соли Na2S. Анион S2- двухзарядный, поэтому гидролиз идет по двум ступеням: 1 ступень: 2 ступень:
S2- + Н2О <=> HS- + ОН- HS- + Н2О<=>H2S + ОН- Na2S + Н2О <=> NaHS + NaOH NaHS + Н2О <=> H2S + NaOH Ионные уравнения показывают, что: а) гидролизу подвергаются анионы S2-; б) в результате гидролиза накапливаются ионы ОН-, которые сообщают среде щелочную реакцию (рН > 7).
|
||||||
|
Последнее изменение этой страницы: 2020-11-22; просмотров: 434; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.97.189 (0.011 с.) |
 (2 мл 0.1 моль/л раствора NH4OH + 2 мл 0.1 моль/л раствора NH4Cl).
(2 мл 0.1 моль/л раствора NH4OH + 2 мл 0.1 моль/л раствора NH4Cl).

 Н Z+
Н Z+ Anz-.... H Z-
Anz-.... H Z- 
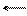
 Anz- O <=> HAn(z-l)-+ ОН-
Anz- O <=> HAn(z-l)-+ ОН-


