
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Элементы одной группы имеют одинаковое строение внешнего электронного слоя. Число электронов на внешнем уровне равно номеру группы.
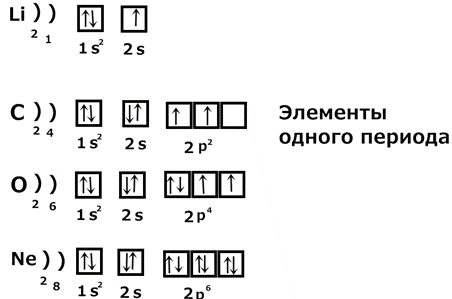
2) Рассмотрим заполнение уровней у элементов одного периода:
Элементы одного периода имеют одинаковое число энергетических уровней. Это число равно номеру периода. Физический смысл периодического закона: периодическое изменение свойств химических элементов и их соединений с увеличением порядкового номера объясняется тем, что периодически повторяется строение внешнего электронного слоя в атомах элементов. Периодическая система Д.И. Менделеева – это наглядное графическое изображение периодического закона. Наиболее распространена её так называемая короткопериодная форма. В структуре таблицы выделяют периоды, группы и подгруппы. Периодом называют горизонтальную совокупность элементов, расположенных в порядке возрастания заряда ядра. Каждый период начинается s - элементом с конфигурацией внешнего энергетического уровня ns1 и завершающийся p - элементом с конфигурацией внешнего энергетического уровня ns2np6 (кроме первого периода, который заканчивается гелием – 1s2). Номер периода определяется значением главного квантового числа внешнего энергетического уровня. Первые три периода называют малыми и состоят они только из s - и и - элементов. Четыре остальных периода называют большими. В составе четвёртого и пятого периодов появляются d - элементы, а в шестой и седьмой периоды входят f - элементы. В связи с закономерным изменением электронного строения атомов в пределах малых периодов свойства элементов изменяются резко, в больших периодах – медленно. Группой называют совокупность элементов, расположенных в таблице вертикально в порядке возрастания заряда ядра. В периодической системе находится 8 групп, так как на внешнем энергетическом уровне не может быть больше восьми валентных электронов. Каждая группа состоит из главной и побочной подгрупп. В состав главных подгрупп входят только s - или p - элементы, а побочных – d - и f - элементы. Просматривается четкая связь между электронной структурой атомов и его положением в таблице: 1) номер элемента совпадает с величиной положительного заряда ядра, числом протонов и электронов; 2) номер периода показывает число электронных оболочек или энергетических уровней и значение главного квантового числа;
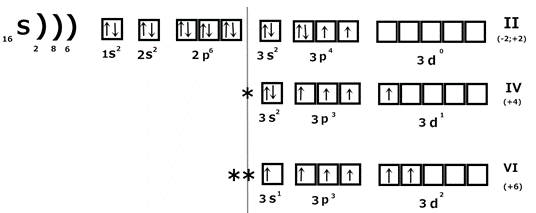
3) номер группы показывает число валентных электронов. Для s - и p - элементов валентные электроны находятся на внешнем энергетическом уровне, для d - элементов на s - и p -подуровнях внешнего и d - подуровне предпоследнего уровня; 4) элементы главных и побочных подгрупп отличаются по заполнению электронных оболочек (у главных подгрупп заполняются s - и p - уровни, у побочных d - и f - уровни); 5) высшая валентность по кислороду равна номеру группы. Спиновая теория валентности Понятие валентности было введено в 1853г английским ученым Франкландом. Валентность элемента – это число химических связей, которые атом данного элемента образует с другими атомами в данной молекуле. Согласно современным представлениям валентность элемента определяется тремя факторами: 1) числом неспаренных электронов; 2) наличием свободных орбиталей и возможностью распаривания электронов; 3) наличием неподеленных электронных пар на внешнем уровне и возможностью донорно-акцепторного взаимодействия. Рассмотрим на примере серы:
Сера в основном состоянии имеет валентность II, в возбужденном - IV и VI. 1.1.1. Контрольные задания 1-10 Для атомов и ионов указанных элементов: а) представьте электронную структуру; б) изобразите графически нормальное и возбужденное состояние; в) укажите валентные электроны.
1.1.2. Контрольные задания 11-20
Для указанных молекул изобразите геометрическую форму, характер перекрывания валентных орбиталей, укажите вид химической связи, возможный тип гибридизации атомных орбиталей.
1.2. Количественные расчеты в химии Основная единица измерения количества вещества в химии – моль (υ). Моль - количество вещества, содержащее 6,02 ∙ 1023 структурных единиц (атомов, ионов, молекул). Масса одного моля – молярная масса (М) рассчитывается из данных периодической системы Д.И. Менделеева. Кроме понятия молярной массы существует понятие молярного объема (Vm). Молярный объем газов при нормальных условиях составляет 22,4 литра. Количество вещества может быть рассчитано по формуле:
где υ - число молей; m – масса вещества, г; М – молярная масса, г/моль. Для газообразных веществ:
где V – объем, занимаемый газом при нормальных условиях (T=273K, p=1атм), Vm – молярный объем = 22,4 л/моль. Пример 1. Найти количество вещества оксида серы (VI) массой 16 г? Решение: Молярная масса оксида серы (VI) составляет: M (SO3)=А (S) + 3 А (O) = 32+3∙16=80 г/моль. Количество вещества SO3 рассчитывается по формуле: υ(SO3)=m/M=16/80=0.2 моль Пример 2. Сколько атомов фосфора содержится в фосфоре массой 93г? Решение: определяем количество вещества атома фосфора: υ(Р)=93/31=3моль. Находим число атомов фосфора, зная, что 1 моль содержит 6.02×1023 частиц. N=6.02×1023×3=1.806×1024 атомов. Пример 3. Определите объем, который займет при нормальных условиях газовая смесь, содержащая кислород массой 2.5 г и азот массой 9.6 г. Решение: Находим количество вещества кислорода в смеси. Молярная масса кислорода составляет 32 г/моль, тогда υ(O2)=2.5/32=0.078 моль. Находим количество вещества азота в смеси. Молярная масса азота составляет 28 г/моль, тогда υ(N2)=9.6/28=0.342 моль. Общее число молей газа в смеси: υ(O2 + N2)= 0.078+0.342=0.42 моль. Находим объем смеси газов V= υ×22.4=0.42×22.4=9.4 л. Пример 4. В состав химического соединения входит кальций, фосфор и кислород. Массовые доли элементов составляют в %: кальция – 38.7, фосфора – 20, кислорода – 41.3. Определить простейшую формулу соединения. Решение: Для расчета выбираем массу соединения, равную 100 г. В этом случае массы кальция, фосфора и кислорода составят: m (Ca) = 38.7 г, m (P) =20 г, m (O) = 41.3 г. Определяем количество вещества кальция, фосфора и кислорода: υ(Ca)=38.7/40=0.967 моль; υ(P)=20/31=0.645 моль; υ(O)=41.3/16=2.58 моль. Отношение количеств вещества составляет υ(Ca): υ(P): υ(O) = 0.967:0.645:2.58. Разделив правую часть равенства на меньшее число (0.645), получаем: υ(Ca): υ(P): υ(O) =1.5:1:4. Для получения целочисленных коэффициентов, правую часть уравнения умножаем на два υ(Ca): υ(P): υ(O) =3:2:8. Простейшая формула соединения Ca3P2O8 или Ca3(PO4)2. Пример 5. Вычислите массу фосфорной кислоты, которую можно получить из ортофосфата кальция массой 80 кг с избытком серной кислоты. Решение: Запишем уравнение происходящей реакции Ca3(PO4)2 + 3H2SO4 = 2H3PO4+3CaSO4 Рассчитываем количество вещества фосфата кальция υ(Ca3(PO4)2) = 80/310= 0.258 моль. Из уравнения реакции видно, что количество вещества фосфорной кислоты вдвое больше количества фосфата кальция, т.е.: υ(H3PO4) = 2∙υ(Ca3(PO4)2) = 2×0.258 = 0.516 моль. Находим массу образовавшейся фосфорной кислоты, учитывая что её молярная масса равна 98 г/моль: m (H3PO4) = υ×М=0.516 моль×98 г/моль=50.568 г.
1.2.1. Контрольные задания 21-30 Закончите уравнение реакции и рассчитайте массу вещества (подчеркнуто), вступившего в реакцию с указанным реагентом. 21. CO2+ 2NaOH = 26. Fe(OH)3+ H2SO4 = 10л 20.5 г
22. Ca(OH)2 +2HNO3= 27. BaCl2 +H2SO4= 16 г 196 г 23. Сa3(PO4)2+ 2HNO3 = 28. Сa(HCO3)2 = CaCO3+ 300 г 100 г 24. 2NH3+ H2SO 4 = 29. NH3 + H2SO4 = 44.8 л 100 г 25. Zn + HNO3(разб)= 30. Ca(OH)2+ H 2 SO4 = 12.6 г 50 г
1.3. Классы и номенклатура неорганических соединений В настоящее время известно более 100 тысяч неорганических веществ. Все неорганические вещества можно разделить на классы. Каждый класс объединяет вещества, сходные по составу и свойствам. Все неорганические вещества делятся на простые и сложные. Простые вещества подразделяются на металлы, неметаллы и инертные газы. По современной классификации сложные неорганические вещества принято делить на 3 класса: оксиды, гидроксиды и соли. Оксиды Оксидами называются сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления – 2. Оксиды делятся на две группы: несолеобразующие и солеобразующие оксиды. К несолеобразующим оксидам относятся, например N2O, NO, SiO, CO, H2O. Эти оксиды не образуют солей при взаимодействии с кислотами и основаниями. Солеобразующие оксиды – это оксиды, которые образуют соли при взаимодействии с кислотами или основаниями. По характеру химических свойств солеобразующие оксиды делятся на три группы: основные оксиды, кислотные и амфотерные. Основные оксиды – это оксиды металлов с валентностью I и II, например: CaO, BaO, Na2O, K2O, CrO, MnO. Исключения составляют: ZnO, BeO, SnO, PbO – это амфотерные оксиды. Названия оксидов: CaO - оксид кальция, Na2O – оксид натрия, CrO – оксид хрома (II), MnO - оксид марганца (II). Если валентность металла постоянна, она не указывается, если валентность металла переменная, она указывается в скобках. Кислотные оксиды К кислотным оксидам относятся два типа оксидов: 1) Все оксиды неметаллов, например CO2,SO2, P2O5 и другие. Названия: CO2 – оксид углерода (IV), P2O5 – оксид фосфора (V). 2) Оксиды металлов с валентностью V и выше. Например: CrO3, Mn2O5, Mn2O7. Названия: CrO3 – оксид хрома (VI), Mn2O5 – оксид марганца (V), Mn2O7 - оксид марганца (VII). Амфотерные оксиды
К амфотерным оксидам относятся те оксиды, которым соответствуют амфотерные гидроксиды. Все амфотерные оксиды являются оксидами металлов.К ним относятся: 1) Исключения, оксиды металлов с валентностью II: ZnO, BeO, SnO, PbO. 2) Оксиды металлов с валентностью III и IV, например Cr2O3, MnO2, Fe2O3. Таким образом, неметаллы образуют только кислотные оксиды, металлы образуют основные, кислотные и амфотерные оксиды. Гидроксиды К гидроксидам в настоящее время относят основания, кислородсодержащие кислоты и амфотерные основания. Основания – это сложные вещества, молекулы которых состоят из атомов металла и одной или нескольких гидроксильных групп – OH. Общая формула оснований Me (OH) n, где n – число гидроксильных групп, равное валентности металла Me. По числу гидроксильных групп в молекуле основания делятся на: - однокислотные, молекулы которых содержат одну гидроксильную группу, например NaOH, KOH и др.; - двухкислотные,молекулы которых содержат две гидроксильные группы, например Сa(OH)2, Fe(OH)2 и др.; - трехкислотные,молекулы которых содержат три гидроксильные группы, например Ni(OH)3, Fe(OH)3 и др.; По растворимости в воде основания делятся на: - растворимые в воде основания или щелочи: LiOH, NaOH, KOH, RbOH, CsOH, Сa(OH)2, Sr(OH)2, Ba(OH)2; - нерастворимые основания: Fe(OH)2, Cu(OH)2 и др. Названия оснований: NaOH – гидроксид натрия, Fe(OH)2 – гидроксид жедеза (II). Амфотерные гидроксиды – это сложные вещества, которые имеют свойства кислот и оснований, они соответствуют амфотерным оксидам. Формулы амфотерных гидроксидов можно записывать в форме оснований и в форме кислот. Примеры амфотерных гидроксидов: Zn(OH)2 = H2ZnO2; Al(OH)3 = H3AlO3 Для амфотерных гидроксидов характерны свойства и оснований и кислот. Кислоты – это сложные вещества, содержащие атомы водорода, которые могут замещаться атомами металлов, в результате чего образуются соли. Общая формула кислот Нn(Ас), где Ас – кислотный остаток, n –число атомов водорода, равное валентности кислотного остатка. Примеры кислот: H2SO4, HNO3, H3PO4. Классификация кислот: 1) по основности: Основность кислоты – это число атомов водорода, которые в молекуле кислоты могут замещаться атомами металла. По основности кислоты делятся на: - одноосновные, молекулы которых содержат один атом водорода: HCl, HCN, HNO3 и др.; - двухосновные, молекулы которых содержат два атома водорода: H2SO4, H2SO3, H2СO3 и др.; - трехосновные, молекулы которых содержат три атома водорода: H3PO4, H3ВO3, H3АsO4 и др.; 2) По содержанию атомов кислорода в молекуле кислоты делятся на: - бескислородные, молекулы которых не содержат атомов кислорода: HCl, HCN, H2S и др.; - кислородсодержащие, молекулы которых содержат атомы кислорода: HNO3, H2SO4, H3PO4 и др. Кислородсодержащие кислоты относят к гидроксидам. Они являются продуктами соединения кислотных оксидов с водой. Например: SO3 + H2O= H2SO4 Важнейшие кислоты: HCl- соляная, HNO3- азотная, H2SO4-серная, Названия других кислот приведены в таблице 4 в разделе «Приложения». Соли – это сложные вещества, в состав которых входят катионы металлов и кислотные остатки. Различают средние, кислые, основные, комплексные и двойные соли.
Средние соли можно рассматривать как продукты полного замещения атомов водорода в кислоте на атомы металла или гидроксид-ионов в основании на кислотный остаток кислоты. Например: 3CaCl2 + 2H3PO4 → Ca3(PO4)2↓ + 6HCl Номенклатура средних солей Название средней соли составляется из названия кислотного остатка кислоты и названия катиона металла с указанием в скобках его валентности римскими цифрами. Например: СuСОз - карбонат меди (II), Сu2CO3 - карбонат меди (I), МgSO4 - сульфат магния, Ва3(PO4)2 - фосфат бария, К2S - сульфид калия. Если атомы водорода в кислоте частично замещены на металл, то кислотный остаток будет содержать один или несколько атомов водорода, и соль, образованная таким кислотным остатком, называется кислой солью. Кислые соли могут образовывать лишь многоосновные кислоты. Например, в ортофосфорной кислоте может происходить последовательное замещение атомов водорода на атом металла, и она способна образовывать две кислых соли: КН2PO4 и K2HPO4 или Mg(H2PO4)2 и MgHPO4. Номенклатура кислых солей Название соли составляется аналогично средним солям с прибавлением приставки "гидро". Например: КН2PO4 – дигидрофосфат калия, К2HPO4 - гидрофосфат калия, Са(НСОз)2 - гидрокарбонат кальция. Основные соли - являются продуктами неполного замещения гидроксид - ионов в основании на кислотный остаток кислоты. Такие соли содержат в своем составе гидроксид-ион ОН−. Например, СuОНСl, (СаОН)2СОз, ВаОНNОз. Номенклатура основных солей Название основной соли составляется из названия средней соли с добавлением приставки «гидроксо». Например, CuOHCl – гидроксохлорид меди (II), (CaOH)2CO3 – гидроксокарбонат кальция, Al(OH)2NO3 – дигидроксо нитрат алюминия. Превращение кислых и основных солей в средние возможно осуществить при взаимодействии их с соответствующими основными или кислотными гидроксидами, например: Ca(HCO3)2 + Ca(OH)2 → 2CaCO3 + 2H2O (CaOH)2SO4 + H2SO4→ 2CaSO4 + 2H2O Комплексные соли, например K4[Fe(CN)6] –гексацианоферрат (II) калия, Na[Al(OH)4] – терагидроксоалюминат натрия. Встречаются также двойные соли, в молекулах которых содержатся два разных катиона: KAl(SO4)2 - сульфат алюминия-калия, СaBa(CO3)2 – карбонат кальция-бария. Существуют и так называемые смешанные соли, которые образованны одним и тем же катионом металла, но различаются анионами, например: BaClNO3 – хлорид-нитрат бария. С химическими свойствами неорганических соединений студенты должны ознакомиться самостоятельно по рекомендуемой литературе. 1.3.1. Методические указания и уровень требований к знаниям студентов по теме Студент должен: знать: - классы неорганических соединений на основании характерных химических свойств; - номенклатуру химических соединений; уметь: - изображать формулы неорганических соединений по их названию; - записывать уравнения взаимопревращений различных классов соединений; - на основе химических свойств соединений прогнозировать поведение конкретного соединения в окружающей среде (атмосфере, почве, воде); владеть: - методами решения задач по неорганической химии.
1.3.2. Контрольные задания 31-40 Осуществите превращения между веществами в схемах; составьте соответствующие уравнения реакций:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-22; просмотров: 449; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.165.246 (0.068 с.) |
 (1.1);
(1.1);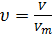 , (1.2);
, (1.2);


