Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Is – диаграмма водяного пара.Стр 1 из 5Следующая ⇒
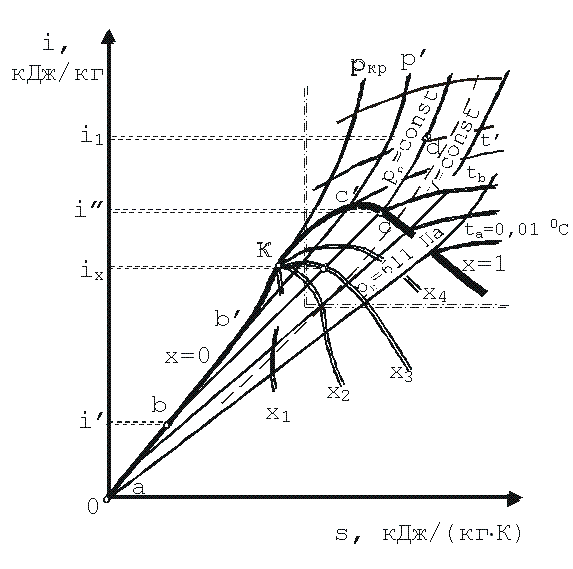
Is – диаграмма водяного пара. Для практических расчетов процессов водяного пара широкое применение получила is -диаграмма, на которой теплота и энтальпия измеряются линейными отрезками. В системе координат i—s (рис. 1) сначала строятся нижняя (а-К) и верхняя (К—с) пограничные кривые по табличным данным i и s. Нижняя пограничная кривая проходит через начало координат, так как при t =0 0С энтропия и энтальпия приняты равными нулю.
Затем наносят изобары, которые в области насыщенного пара, будучи одновременно и изотермами, являются прямыми линиями, так как при p=const, dq=di, а ds = dq/ T = di/ T. Поэтому di=T·ds и при T=const, i=T·s+const. Следовательно, на is -диаграмме угловой коэффициент изобары равен T. Поэтому чем выше давление насыщения, тем выше температура T и тем больше тангенс угла наклона изобары. В области перегретого пара изобары и изотермы расходятся, причем изобары поднимаются кверху в виде логарифмических кривых, а изотермы стремятся к горизонтали. Это объясняется тем, что с понижением давления перегретый пар по свойствам приближается к идеальному газу, энтальпия которого зависит только то температуры, то есть линии t =const одновременно являются линиями i =const. Чем больше температура, тем выше расположена изотерма. В области влажного пара нанесены линии одинаковой степени сухости х =const. На эту же диаграмму часто наносят еще изохоры, которые проходят круче изобар. Is -диаграмма обладает рядом важных свойств: по ней можно быстро определить параметры пара и разность энтальпий в виде отрезков, наглядно изобразить адиабатный процесс, имеющий большое значение при изучении работы паровых двигателей, и решать другие задачи. Обычно для практического использования в большом масштабе строят так называемую рабочую часть диаграммы (на рис. 1. она ограничена штрих-пунктиром). Процессы водяного пара на is-диаграмм: Как уже отмечалось, пар как реальный газ не подчиняется простым закономерностям идеальных газов, поэтому расчеты процессов с водяным паром проводятся с помощью таблиц или графически с помощью диаграмм. Наиболее удобно оценивать характер изменения параметров разных процессов по is-диаграмме. Основные термодинамические процессы водяного пара (v=const, p=const, t=const) представлены на is -диаграмме соответствующими кривыми. Адиабатный процесс (s =const) изображается прямой, параллельной оси ординат. Следует обратить особое внимание на разные закономерности изменения параметров состояния пара в термодинамических процессах в зависимости от состояния пара (насыщенный или перегретый). Так, в изотермическом процессе в области насыщенного пара энтальпия изменяется значительно, а в области перегретого пара, особенно вдали от линии х =1, процесс t =const приближается к i =const. Это свидетельствует о том, что свойства перегретого пара в этих областях приближаются к свойствам идеального газа.
Температурное поле. Температурное поле - совокупность значений температур во всех точках рассматриваемого пространства в данный момент времени. Для установившихся (стационарных) режимов Температурное поле от времени не зависит. Во многих случаях может рассматриваться зависимость Температурное поле от двух, а иногда от одной координаты. Графически Температурное поле изображают посредством изотермических поверхностей, соединяющих все точки поля с одинаковой температурой, а для двухмерного поля - посредством семейства изотерм. Расстояние между изотермами обратно пропорционально градиенту температуры; при этом скалярному Температурное поле соответствует векторное поле градиентов температуры После 2-го интегрирования: t = C1 x + C 2. Для определения констант интегрирования используем следующие формулы: при х =0, следует что t C 1 = C 2; при х = δ, получаем – t = tC 2 = C 1 * δ + C 2 = C 1 * δ + t C 1. Отсюда выразим С1: С1 = (t C 1 – tC 2)/ δ. Используя выражения определения С1 найдем t: t = tC1 – ((t C1 – tC2)/ δ)* x. Изотермическая поверхность. Изотермическая поверхность – это геометрическое место точек с одинаковой температурой. Изотермы не могут пересекаться, т.к. не может быть 2-х разных температур в точках в один и тот же момент времени. Они замыкаются сами на себя (t1 = const; t2 = const) и заканчиваются в окружающем пространстве (t3 = const). Если изотермические поверхности рассечь плоскостью, то в сечении получим изотермические линии, которые обладают теми же свойствами, что и изотермические поверхности.
Основные понятия о лучистом теплообмене. Лучистый поток. Плотность излучения, монохроматическое излучение, эффективное и результирующее излучение. Тепловое излучение есть результат превращения внутренней энергии тел в энергию электромагнитных колебаний. При попадании тепловых лучей (волн) на другое тело их энергия частично поглощается им, снова превращаясь во внутреннюю. Так осуществляется лучистый теплообмен между телами. Тепловое излучение как процесс распространения электромагнитных волн характеризуется длиной волны λ и частотой колебаний ν = c /λ, где с — скорость света. Все виды электромагнитного излучения имеют одинаковую природу, поэтому классификация излучения по длинам волн в зависимости от производимого ими эффекта носит лишь условный характер. При температурах, с какими обычно имеют дело в технике, основное количество энергии излучается при длине волны 0,8-80 мкм. Эти лучи принято называть тепловыми (инфракрасными). Тепловой поток, излучаемый на всех длинах волн с единицы поверхности
Это уравнение теплового баланса можно записать в безразмерной форме: A+R+D=1. А = ЕА/ Е пад - коэффициент поглощения, E=ER/ Е пад - коэффициентом отражения, D = ED/ Е пад – коэффициентом пропускания. Тело, поглощающее все падающее на него излучение, называется абсолютночерным. Для этого тела А = 1. Тела, для которых коэффициент А < 1 и не зависит от длины волны падающего излучения, называются серыми. Для абсолютно белого тела R = 1, для абсолютно прозрачного D = 1. Если поверхность поглощает тепловые лучи, но не поглощает световые, она не кажется черной. Более того, наше зрение может воспринимать такую поверхность как белую, например снег, для которого A = 0,98. Стекло, прозрачное в видимой части спектра, почти не прозрачно для тепловых лучей (А =0,94). Твердые и жидкие тела в большинстве излучают энергию всех длин волн т.е. имеют сплошной спектр излучения (хотя наибольшее количество энергии испускается в пределах длин волн от 0,8 до 80мкм). Чистые (неокисленные) металлы и газы характеризуются выборочным — селективным излучением, т. е. излучают энергию только определенных длин волн. В большинстве твердых и жидких тел поглощение тепловых лучей завершается в тонком поверхностном слое, т. е. не зависит от толщины тела. Для этих тел тепловое излучение обычно рассматривается как поверхностное явление. В газе в силу значительно меньшей концентрации молекул процесс лучистого теплообмена носит объемный характер. Коэффициент поглощения газа зависит от размеров («толщины») газового объема и давления газа, т. е. концентрации поглощающих молекул. Сумма потоков собственного и отраженного телом излучения называется его эффективным излучением: E эф = E + E пад. Суммарный процесс взаимного испускания, поглощения, отражения и пропускания энергии излучения в системах тел называется лучистым теплообменом.Q – интегральный или полный лучистый поток – суммарное излучение с поверхности твердого тела в единицу времени по всем направлениям полусферического пространства и по всем длинам волн. Q λ – поток монохроматического, спектрального или однородного излучения – излучение с поверхности твердого тела в единицу времени, относящееся к узкому интервалу изменений длин волн от λ до dλ. E = dQ / dF – интегральная плотность полусферического излучения или излучательная способность тела – интегральный лучистый поток, испускаемый с единицы поверхности тела по всем направлениям полусферического пространства. Лучистый поток по всей поверхности можно выразить как
Q = ∫ F E * dF, eсли E = const, то Q = E * F. Здесь F – полная поверхность тела. Собственное излучение (Q, E) определяется природой данного тела и его температурой. Обычно тело участвует в теплообмене с другими телами, энергия излучения которых, попадая на данное тело, частично им поглощается, частично отражается, а часть ее проходит сквозь тело. Падающее излучение (Q пад или E пад) – количество лучистой энергии, падающее на данное тело. Часть падающей энергии, которую тело отражает обратно окружающим его телам, носит название отраженного излучения: Q отр = R *Q пад или E отр = R* E пад, где R – коэффициент отражения. Если R = 1 и процессы отражения подчиняются законам геометрической оптики, то поверхность называется зеркальной; при диффузном отражении (т.е. энергия испускается телом равномерно во всех направлениях) поверхность называют абсолютно белой. Часть падающей энергии излучения, проходящая сквозь тело, называется пропускательным излучением: Q проп = D *Q пад или E проп = D* E пад, где D – коэффициент проницаемости. Тела, у которых D = 1, называются проницаемыми, прозрачными или диатермичными телами (тонкие слои сухого воздуха, одноатомных газов). Для твердых и жидких тел принимается D = 0, так как они поглощают лучистую энергию в тонком поверхностном слое. Результирующее излучение представляет собой разность между лучистым потоком, получаемым данным телом, и лучистым потоком, испускаемым в окружающее его пространство. Результирующее излучение может быть определено двумя способами: q рез = E – E погл = E – A* E пад или q рез = E эф – E пад. Тогда эффективное излучение может быть определено как: E эф = 1/ A *[ E – (1 - A)* q рез ].
is – диаграмма водяного пара. Для практических расчетов процессов водяного пара широкое применение получила is -диаграмма, на которой теплота и энтальпия измеряются линейными отрезками. В системе координат i—s (рис. 1) сначала строятся нижняя (а-К) и верхняя (К—с) пограничные кривые по табличным данным i и s. Нижняя пограничная кривая проходит через начало координат, так как при t =0 0С энтропия и энтальпия приняты равными нулю.
Затем наносят изобары, которые в области насыщенного пара, будучи одновременно и изотермами, являются прямыми линиями, так как при p=const, dq=di, а ds = dq/ T = di/ T. Поэтому di=T·ds и при T=const, i=T·s+const. Следовательно, на is -диаграмме угловой коэффициент изобары равен T. Поэтому чем выше давление насыщения, тем выше температура T и тем больше тангенс угла наклона изобары. В области перегретого пара изобары и изотермы расходятся, причем изобары поднимаются кверху в виде логарифмических кривых, а изотермы стремятся к горизонтали. Это объясняется тем, что с понижением давления перегретый пар по свойствам приближается к идеальному газу, энтальпия которого зависит только то температуры, то есть линии t =const одновременно являются линиями i =const. Чем больше температура, тем выше расположена изотерма. В области влажного пара нанесены линии одинаковой степени сухости х =const. На эту же диаграмму часто наносят еще изохоры, которые проходят круче изобар. Is -диаграмма обладает рядом важных свойств: по ней можно быстро определить параметры пара и разность энтальпий в виде отрезков, наглядно изобразить адиабатный процесс, имеющий большое значение при изучении работы паровых двигателей, и решать другие задачи. Обычно для практического использования в большом масштабе строят так называемую рабочую часть диаграммы (на рис. 1. она ограничена штрих-пунктиром). Процессы водяного пара на is-диаграмм: Как уже отмечалось, пар как реальный газ не подчиняется простым закономерностям идеальных газов, поэтому расчеты процессов с водяным паром проводятся с помощью таблиц или графически с помощью диаграмм. Наиболее удобно оценивать характер изменения параметров разных процессов по is-диаграмме. Основные термодинамические процессы водяного пара (v=const, p=const, t=const) представлены на is -диаграмме соответствующими кривыми. Адиабатный процесс (s =const) изображается прямой, параллельной оси ординат. Следует обратить особое внимание на разные закономерности изменения параметров состояния пара в термодинамических процессах в зависимости от состояния пара (насыщенный или перегретый). Так, в изотермическом процессе в области насыщенного пара энтальпия изменяется значительно, а в области перегретого пара, особенно вдали от линии х =1, процесс t =const приближается к i =const. Это свидетельствует о том, что свойства перегретого пара в этих областях приближаются к свойствам идеального газа.
|
||||||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 756; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.243.194 (0.019 с.) |