Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Адсорбционная хроматография.
Хроматография — метод разделения и анализа смесей веществ, а также изучения физико-химических свойств веществ. Основан на распределении веществ между двумя фазами — неподвижной (твёрдая фаза) и подвижной (газовая или жидкая фаза, элюент). Адсорбционная хроматография — разделение за счёт адсорбции основано на различии адсорбируемости компонентов смеси на данном адсорбенте; вид хроматографии, при которой разделение веществ, входящих в смесь и движущихся в потоке подвижной фазы, происходит за счёт их различной способности адсорбироваться и десорбироваться на поверхности адсорбента с развитой поверхностью, например, силикагеля. Процесс взаимодействия может сопровождаться химическим взаимодействием примесей с неподвижной фазой, то есть хемосорбцией.
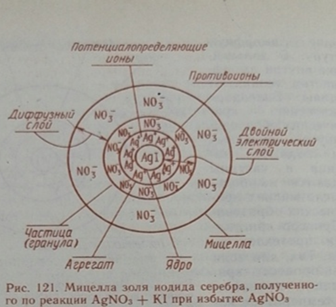
Факторы устойчивости коллоидных растворов. Для устойчивых коллоидных систем необходимо: 1. Размеры частиц должны составлять от 1 до 100 миллимикрон.
2. Присутствие стабилизатора (электролит). Он сообщает коллоидным частицам одноименный заряд на поверхности, противоположный заряд имеет среда вокруг частиц => не слипаются. 3. Фаза должна обладать плохой растворимостью. Механизм коагуляции под действием электролитов. Правила коагуляции: 1. Все сильные электролиты, добавленные к золю в достаточном количестве, вызывают его коагуляцию. Минимальная концентрация электролита, вызывающая коагуляцию золя за определённый короткий промежуток времени, называется порогом коагуляции. Величина, обратная порогу коагуляции, называется коагулирующей способностью электролита. Значит, чем меньше порог коагуляции, тем больше коагулирующая способность электролита. 2. Коагулирующим действием обладает не весь электролит. Заряд коагулирующего иона противоположен заряду коллоидной частицы. Этот ион называют ионом – коагулянтом. 3. Коагулирующая способность иона – коагулянта тем больше, чем больше заряд иона. 4. Коагулирующая способность иона при одинаковом заряде тем больше, чем больше его кристаллический радиус. Для однозарядных неорганических катионов коагулирующая способность убывает в следующем порядке: Ag +> Cs+> Rb+> NH4+> K+> Na+> Li+. Этот ряд называется лиотропным.
Коллоидная защита. Процесс повышения устойчивости гидрофобного золя, путем добавления к нему небольшого количества молекулярного коллоида (раствор высокого молекулярного соединения - ВМС). Механизм защитного действия – макромолекулы ВМС адсорбируются на поверхности коллоидных частиц, усиливая этим доп заряд и гидратную оболочку. Значение коллоидной защиты велико, например, белки крови защищают капельки жира, холестерин и др гидрофобные вещества от коагуляции. Ослабление защитных свойств белков приводит к отложению холестерина на стенках сосудов, к образованию камней в печени и почках.
Студни. Не текучие дисперсные системы. Студнями являются и ткани организма – клеточные мембраны, протоплазма, кожа, хрусталик, ногти, рога, копыта. Продукты питания студни – сыр, хлеб, холодец. Классификация:
1. По природе среды – гидрогели (вода), органогели (алкогели, глицерогели, бензогели). 2. По природе фазы – неорганические (неэластичные, хрупкие, не возвращающие обратное состояние после высушивания при добавлении воды); органические (эластичные, обратимые после высушивания). 3. По содержанию среды – лиогели (богатые дисперсионной средой – кисель, студень); ксерогели или сухие студни – воды до 2%).
Методы получения студней. 1.Застудневание золя и р-ра высокомолекулярных соединений. Процесс застудневания – а) Концентрация, форма и размер коллоидных частиц. Для каждого студня есть своя минимальная концентрация частиц фазы, ниже которой студень не образуется; б) Температура, время, рН ра-ра и присутствие электролита. 2. Ограниченное набухание сухого ВМС в подходящей среде. Набухание полимера – самопроизвольное поглощение р-ля полимера. С набуханием связаны процессы роста и развития организма, получение продуктивности животных. С возрастом степень набухания белков организма снижается и организм «высыхает».
|
||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 251; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.100.180 (0.007 с.) |