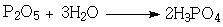Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Технология производства аскорбиновой кислоты
Стадия 1. Производство D-сорбита из D-глюкозы. В производстве синтетической аскорбиновой кислоты D-сорбит является первым промежуточным продуктом синтеза. D-сорбит представляет собой белый кристаллический порошок, легко растворимый в воде. Сырьем для его производства является D-глюкоза. Это сравнительно дорогое сырье, стоимость его составляет 40‒44% от себестоимости аскорбиновой кислоты, поэтому замена D-глюкозы на непищевые виды сырья является важной проблемой. Процесс восстановления D-глюкозы можно осуществлять двумя методами: ‒ электролитическим восстановлением; ‒ каталитическим гидрированием. Электролитическое восстановление D-глюкозы в D-сорбит осуществляется при комнатной температуре в электролизерах со свинцовыми анодами и катодами из сплава никеля. Процесс проводят в присутствии NaОH и сульфата натрия или аммония при рН=10. Преимуществом процесса является его проведение в мягких условиях, в отсутствии дорогостоящих катализаторов и автоклавов. Однако в процессе электролитического восстановления получается раствор D-сорбита, загрязненный его изомером ‒ D-маннитом (до 15%). Разделение этих изомеров представляет большие трудности. Недостатком процесса является также высокая щелочность раствора и сложность конструкции электролизера. Поэтому в настоящее время на витаминных предприятиях принят каталитический метод. Каталитическое гидрирование (восстановление) можно представить следующей схемой:
Выход составляет 98 – 99% от теоретически возможного. Особенностью этой стадии производства является протекание ряда побочных реакций: окисление D-глюкозы (I) в D-глюконовую кислоту (VI) кислородом воздуха в присутствии катализатора; фенолизация D-глюкозы в щелочной среде с последующей изомеризацией в D-фруктозу (II) и D-маннозу (IV). D-фруктоза может далее превращаться в D-сорбит (III) и D-маннит (V). В побочных процессах гидрогенолиза глюкозы, кроме D-сорбита, образуются также этиленгликоль, глицерин, пропиленгликоль и др. побочные продукты. Основные побочные процессы протекают по схеме:
Основная задача при осуществлении технологического процесса ‒ свести к минимуму образование этих побочных продуктов. Это достигается рядом мер, которые будут рассмотрены несколько позже.
Технологическая схема получения D-сорбита включает следующие операции: 1. Приготовление и регенерация скелетного никелевого катализатора; 2. Приготовление 50‒55%-ного раствора D-глюкозы; 3. Получение D-сорбита; 4. Очистка водного раствора D-сорбита от ионов тяжелых металлов; 5. Получение кристаллического D-сорбита для выпуска пищевого D-сорбита. Процесс гидрирования глюкозы осуществляют двумя способами: или автоклавным периодическим способом, или в непрерывно действующих аппаратах [25]. Добавка Е 300 разрешена в РФ и других странах для использования в пищевой промышленности.
Янтарная кислота Янтарная кислота (HООС–СH2–СH2–СООH) – антиоксидант Е 363, бесцветное кристаллическое вещество, растворимое в воде и спирте, Тпл –183 °С. Выше 235°С отщепляет Н2О и переходит в янтарный ангидрид. Она представляет собой побочный продукт производства адипиновой кислоты. Известен также способ ее выделения из отходов янтаря. Используется в пищевой промышленности как регулятор кислотности (обычно добавляют в напитки, карамель, жевательную резинку и т.д.), в ароматизированных сухих десертах, в желеобразных десертах, в порошковых смесях для изготовления напитков дома и консерванта (как альтернатива лимонной кислоте), добавляется, например, в майонез, водку [7].
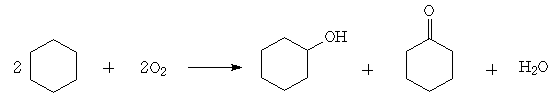
Адипиновая кислота Адипиновая кислота (НООС–(СН2)4–СООН) – антиоксидант Е 355, белое кристаллическое вещество. Получается в промышленности, главным образом, двухстадийным окислением циклогексана. На первой стадии (жидкофазное окисление воздухом при 142‒145°С и 0,7 МПа) получают смесь циклогексанона и циклогексанола, разделяемую ректификацией:
Циклогексанол окисляют оксидом хрома (VI) в присутствии серной кислоты. При этом способе производства неплохой выход адипиновой кислоты.
Обладает всеми химическими свойствами, характерными для карбоновых кислот, в частности, образует соли, большинство из которых растворимо в воде. Легко этерифицируется в моно- и диэфиры. Соли и эфиры адипиновой кислоты получили название адипинаты.
Адипиновая кислота может использоваться как регулятор кислотности (обычно добавляют в напитки, карамель и другие продукты для поддержания необходимого уровня pH), в ароматизированных сухих десертах, в желеобразных десертах, а также в начинках и добавках для хлебобулочных и кондитерских изделий. Адипиновая кислота присутствует в списке добавок, утвержденных Евросоюзом, тем не менее, на данный момент ее использование во многих странах запрещено, так как кислота еще находится на стадии тестирования [26].
Фумаровая кислота Фумаровая кислота (транс – СООH–СH=СH–СООH) – консервант Е 297, представляет собой бесцветные кристаллы, имеющие фруктовый вкус. Содержится во многих растениях и грибах, образуется при брожении углеводов в присутствии Aspergillus fumariсus. Фумаровая кислота также обычно получаются при нагревании до 150°С яблочной кислоты:
Соли и эфиры называются фумаратами. В пищевой промышленности фумаровую кислоту используют в качестве регулятора кислотности при приготовлении карамельных конфет, напитков и других продуктов питания для поддержания требуемого уровня pH. Добавляют добавку в некоторые виды сухих ароматизированных десертов, но в строго установленном количестве – до 1 г/кг готовой продукции. Фосфорная кислота Фосфорная кислота (H3РО4) – антиоксидант Е 338. Представляет собой бесцветные гигроскопичные кристаллы. При температуре выше 42°С ортофосфорная кислота начинает плавиться, превращаясь в вязкую бесцветную жидкость. Хорошо растворима в воде и обычно применяется в виде 85% водного раствора. В таком виде фосфорная кислота представляет собой бесцветную сиропообразную жидкость. Кислота не обладает запахом и также хорошо растворяется во многих растворителях, например в этаноле. Ортофосфорная кислота может быть получена различными способами: 1. Взаимодействием фосфата кальция с серной кислотой:
2. Гидролизом пентахлорида фосфора:
3. Сжиганием фосфора и дальнейшим взаимодействием его оксида с водой:
Её соли – фосфаты (калия, натрия и кальция) широко распространены в пищевом сырье и продуктах его переработки. В высоких концентрациях фосфаты содержатся в молочных, мясных и рыбных продуктах, в некоторых видах злаков и орехов. Фосфаты (пищевые добавки Е 339 – 341) вводятся в безалкогольные напитки и кондитерские изделия. Допустимая суточная доза, в пересчете на фосфорную кислоту, соответствует 5 – 15 мг на 1 кг массы тела (поскольку избыточное количество ее в организме может стать причиной дисбаланса кальция и фосфора) [10]. Добавка Е 338 входит в список разрешенных пищевых добавок в Европейском союзе, Российской Федерации и многих других странах. 1.4. Методы определения кислот в пищевых продуктах В основе определения активной кислотности – pH различных пищевых систем лежат стандартные методы, описанные в руководствах по аналитической химии. К ним относятся калориметрический и электрометрический методы. Определение потенциальной кислотности, характеризующей общее содержание веществ, имеющих кислотный характер, основано на титровании этих веществ сильными основаниями (щелочами). Для различных пищевых продуктов характерны свои особые условия титрования, результаты которых представляют в соответствующих кислотных числах.
Кислотность твердых пищевых продуктов определяют титрованием водных вытяжек растворами щелочей, а кислотность жидких продуктов – путем титрования навесок или объемов. При титровании определяют суммарное содержание в продукте свободных кислот и кислых солей. Результаты титрования выражают в процентах по преобладающей в продукте кислоте или в градусах. Поскольку в лимонах преобладает лимонная кислота, то кислотность лимонов рассчитывают по лимонной кислоте, кислотность винограда – по винной, яблок, груш, слив и томатов – по яблочной, квашеной капусты, молока и кисломолочных продуктов – по молочной [3]. Пример. Для определения кислотности молока берут 10 мл молока, добавляют индикатор и титруют 0,1 и. раствором щелочи. Количество пошедшей на титрование щелочи умножают на 0,009 и получают содержание в молоке молочной кислоты в процентах. Число 0,009 соответствует количеству граммов молочной кислоты, необходимому для приготовления 1 мл 0,1 н. ее раствора. Для приготовления 1 л 0,1 н. раствора надо брать 9 г молочной кислоты, так как это одноосновная оксикислота и ее молекулярный вес равен 90. Под градусом кислотности подразумевается количество миллилитров одно- или децинормальной щелочи, необходимое для нейтрализации кислот и кислых солей, которые содержатся в 100 г или 100 мл испытуемого продукта. Так, кислотность муки выражается в градусах количеством миллилитров 1 н. раствора щелочи, необходимым для нейтрализации кислот в 100 г муки, а кислотность крахмала – числом миллилитров 0,1 н. раствора щелочи на 100 г крахмала. В пищевых продуктах наряду с нелетучими могут находиться летучие кислоты – уксусная, муравьиная, масляная и другие, которые перегоняются с парами воды. По количеству летучих кислот можно судить о качестве таких продуктов, как вино, пиво, плодово-ягодные и овощные соки и др. Допускаемые стандартами нормы летучих кислот должны соответствовать тем количествам, которые могут получиться в продукте из полноценного сырья и при нормальном ходе технологического процесса. Существующие методы определения летучих кислот подразделяют на прямые и косвенные. При прямых методах сначала отгоняют летучие кислоты, которые затем оттитровывают щелочью. При косвенных методах сначала определяют общее количество кислот в растворе, после чего путем выпаривания из него удаляют летучие кислоты.
Анализ кислотного состава пищевого продукта дает возможность обнаружить фальсификацию или подтвердить его натуральность. Для определения содержания органических кислот используют как стандартные, так и альтернативные методы контроля. Официальный метод анализа молочной кислоты основан на ее окислении перманганатом калия до уксусного альдегида, который определяют йодометрически. Наиболее известные методы определения винной кислоты базируются на щелочном титровании выпадающего винного камня. Большинство органических кислот можно определить хроматографическими методами [13]. К альтернативным относятся методы, основанные на использовании ферментативных систем. Характерными особенностями ферментативного анализа являются специфичность, обеспечивающая достоверность результатов, высокие точность и чувствительность [16]. Перечень органических кислот в составе пищевых продуктов, определяемых ферментативными методами, представлен в табл. 6. Таблица 6
|
||||||||
|
Последнее изменение этой страницы: 2020-03-27; просмотров: 354; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.59.218.147 (0.02 с.) |