Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Соли алкилсалициловых кислот.Стр 1 из 5Следующая ⇒
Курсовая работа Тема: " Синтез и исследование алкилсалицилатн ы х присадок " Выполнил: студент 5-го курса химико-технологического факультета группы ХО - 11 Товмаченко Андрей Валентинович Научные руководители: к. х. н., с. н. с. Суховерхов В. Д. к. х. н., доц. Черняев Б. В.
Киев - 2006 Реферат В данной работе рассмотрены основные методы синтеза алкилсалицилатных присадок Детерсол-50, Детерсол-140 и Детерсол-180. Дана подробная характеристика каждого метода, приведён обзор патентов, указаны особенности промышленного производства этих присадок. Проанализированы механизмы ключевых стадий синтеза, указаны особенности применения алкилсалицилатов. Кроме того, в работе приведена классификация алкилсалицилатных присадок и описан механизм их действия. Экспериментальная часть работы включает в себя лабораторный синтез Детерсолов, определение их щёлочности и характеристику исходного сырья. Введение Масла, применяемые для смазки двигателей внутреннего сгорания, называют моторными. В зависимости от назначения их подразделяют на масла для дизелей, масла для бензиновых двигателей и универсальные масла, которые предназначены для смазки двигателей обоих типов. Все современные моторные масла состоят из базовых масел и улучшающих их свойства добавок, так называемых присадок, представляющих собой химические соединения различных классов. Моторные масла, в зависимости от назначения, должны выполнять следующие функции: образовывать устойчивую смазывающую плёнку, предотвращающую контакт и износ трущихся деталей при любых условиях работы техники; эффективно защищать детали двигателя от коррозии; создавать уплотнение в зоне поршневых колец с целью сведения до минимума проникновения продуктов сгорания в картер и масла в камеру сгорания; обладать высокой устойчивостью к окислению при средних (80-120ºС) и высоких (250-300ºС) температурах; предотвращать образование нагара на деталях цилиндро-поршневой группы двигателя за счёт удаления с поверхности деталей смолистых образований, а также шламов, образующихся в картере, за счёт их диспергирования в масле; обладать вязкостно-температурной характеристикой, обеспечивающей подвижность масла при минусовых температурах (возможность запуска двигателя) и достаточной вязкостью при высоких температурах (для смазки верхнего поршневого кольца);
иметь высокую стабильность против механической деструкции; характеризоваться низкой испаряемостью; защищать от ржавения детали двигателей при краткосрочной консервации; не вспениваться. Для обеспечения и улучшения перечисленных требований применяются следующие присадки: вязкостные (улучшают вязкостно-температурные свойства); депрессорные (понижают температуру застывания); антиокислительные (ингибируют окисление масла и образование смолообразных продуктов этого процесса); антикоррозионные (защищают цветные металлы подшипников от коррозионного износа); диспергирующие; моющие (детергентные); смазывающие (противоизносные и антизадирные); антипенные; антиржавейные. Как указывалось выше, присадки представляют собой химические соединения различных классов. Так, антиокислительные присадки - это обычно пространственно затруднённые алкилфенолы, производные дитиофосфорных кислот, аминосодержащие соединения. Противоизносные присадки - это чаще всего серу-, азот-, фосфорсодержащие соединения типа сульфидов, производных дитиофосфорных кислот, дитиокарбаматы. Антикоррозионные присадки - чаще всего соединения сульфонатного типа. Диспергирующие присадки - это высокомолекулярные соединения полиалкилсукцинимидного типа или высокомолекулярные соединения Манниха. Наиболее характерными моющими присадками являются алкилсалицилаты; к таким присадкам также относятся металлсодержащие соединения алкилфенольного и сульфонатного типов. Целью данной работы является синтез и исследование зольных моющих присадок алкилсалицилатного типа, обеспечивающих чистоту деталей двигателя при высоких температурах. Алкилсалицилаты являются важной составной частью моторных масел, потому что эти вещества являются наиболее характерными представителями моющих присадок. Кроме того, данные присадки нейтрализуют кислые соединения, которые образуются при сгорании топлива в двигателе и попадают в картер в составе газов сгорания. Тем самым алкилсалицилаты защищают детали двигателя от кислотной коррозии.
Следует также отметить и то, что рассматриваемые присадки имеют антиокислительное действие. Высокие эксплуатационные свойства алкилсалицилатных присадок, их стойкость к пресной и морской воде обеспечивают им широкую область применения, в частности при создании масел для различных двигателей с тяжёлыми условиями работы [54,55], для карбюраторных двигателей с высокой степенью сжатия, для высокофорсированных дизелей, судовых дизелей с лубрикаторной смазкой, свободнопоршневых дизель-компрессоров и ряда других объектов. Литературный обзор Алкилсалицилатные присадки являются солями или химическими производными алкилсалициловых кислот. Исходными реагентами для синтеза этих кислот являются алкилфенолы, имеющие хотя бы одно свободное орто-положение:
Введение карбоксильной группы в орто-положение ароматического ядра может быть достигнуто несколькими путями.
Карбоксилирование ортометаллалкилфенолята диоксидом углерода
где Ме = Li, Na, K.
Взаимодействие с оксидом углерода:
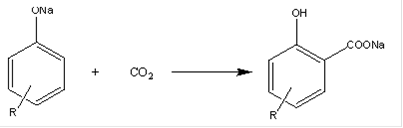
Карбоксилирование алкилфенолятов металлов диоксидом углерода:
где Me = Na, K. Алкилсалициловые кислоты можно получить и алкилированием салициловых кислот [1]. Но из-за малого выхода продуктов алкилирования широкого применения эта реакция не нашла. Карбоксилирование ортометаллалкилфенолята диоксидом углерода Металлирование органических соединений обычно проводят следующими реагентами: бутиллитием -C4H9Li, амилнатрием -C5H11Na, бутилкалием -C4H9K. При этом могут замещаться на металл водород гидроксильной группы, водороды ароматического кольца и алкильных групп. Необходимо учитывать, что наличие заместителей в ароматическом ядре изменяет его реакционную способность, причём она зависит как от химического строения заместителя, так и от места замещения. В литературе отсутствуют данные по металлированию алкилфенолятов, но имеются данные по металлированию алкилбензолов [2,3], которые в известной мере можно использовать при оценке металлирования алкилфенолятов. Установлено, что при металлировании литием или бутиллитием в присутствии N, N, N`, N`-тетраметилэтилендиамина [4], натрий- и калийорганическими соединениями [2,3] происходит замещение водорода не только в ароматическом ядре, но и в алкильной цепи, так как металлированное в кольцо производное подвергается перегруппировке в более стабильный альфа-изомер. Карбоксилирование таких металлсодержащих соединений приведёт к получению сложной смеси карбоновых кислот. В любом случае на металлирование алкилфенолов будет расходоваться не менее двух молекул металлалкила. Если учесть, что металлалкилы относительно дорогостоящие и малодоступные реагенты, то становится очевидным, что синтез алкилсалициловых кислот через металлорганические соединения в промышленном масштабе бесперспективен. Взаимодействие с оксидом углерода Реакция протекает с калиевыми соединениями и приводит к получению п-оксибензойных, а не салициловых кислот. Условия реакции жёсткие: температура 230-260 ºС давление СО 8МПа, продолжительность 5 ч [5]. В зависимости от молекулярной массы алкилфенолов изменяется выход алкилпараоксибензойных кислот от 80% от теории для крезолов до 20% от теории для алкил(С14-С18)фенола.
Следовательно, данный метод получения оксибензойных кислот для крупного промышленного производства является непреемлемлемым. Карбоксилирование алкилфенолятов металлов диоксидом углерода В ряде исследований [6-8] показано, что к преимущественному получению салициловой кислоты приводит карбоксилирование фенолята натрия диоксидом углерода. По имени авторов реакция названа реакцией карбоксилирования по Кольбе-Шмидту. Эта реакция также лежит в основе получения алкилсалициловых кислот. В связи с доступностью реагентов и умеренными условиями осуществления реакции данный метод стал единственным в промышленном производстве алкилсалициловых кислот. Химизм и технологическое осуществление реакции Кольбе-Шмидта рассмотрены ниже. Классификация, состав и получение алкилсалицилатных присадок Как уже было сказано ранее, алкилсалицилатные присадки подразделяются на соли алкилсалициловых кислот и различные производные этих кислот. Рассмотрим первый из этих классов в отдельности. Таблица 2. Состав олефинов фракции 240-320 º С термокрекинга парафинов.
Таблица 3. Состав олигомеров этилена С16-С18.
Химизм процесса
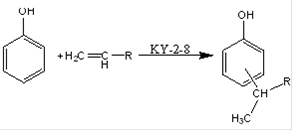
Реакция алкилирования является реакцией электрофильного замещения и катализируется катализаторами кислотного типа: минеральные и органические кислоты, галогениды металлов, катионнообменные смолы, алюмосиликаты. В качестве катализаторов алкилирования фенола высшими олефинами описаны также хлораты металлов, триэтилаллюминий, молекулярный йод, фенолят алюминия и другие. Широкое применение в производстве присадок, при алкилировании фенола высокомолекулярными олефинами получила также бензолсульфокислота (далее БСК). Её каталитическая активность близка к активности H2SO4 и AlCl3. Будучи сильной кислотой, БСК не обеспечивает селективность процесса алкилирования. В её присутствии образуется около 30% диалкилфенолов, главным образом 2,6-замещённых. Существенным недостатком процесса алкилирования фенолов в присутствии растворимых катализаторов (минеральных и органических кислот, галогенидов металлов и их молекулярных соединений) является необходимость отмывки продуктов реакции от катализатора. При этом образуется значительное количество фенольных сточных вод и возникает проблема их очистки, имеют место повышенные потери продукта. Применение нейтрализующих средств, например, аммиака и удаление катализатора в виде аммонийных солей фугованием не всегда обеспечивает полную очистку продуктов алкилирования от катализатора. Указанных недостатков лишён метод алкилирования фенолов с применением гетерогенных катализаторов (катионообменные смолы, алюмосиликаты, синтетические цеолиты и др.). К тому же указанные катализаторы являются менее сильными кислотами, что в значительной мере обеспечивает селективность процесса. В настоящее время алкилирование фенола олефинами в промышленности осуществляют в реакторах колонного типа на кислотном гетерогенном катализаторе сульфокатионите КУ-2-8, представляющим собой сульфированный сополимер стирола и дивинилбензола. В результате набухания полимера молекулы фенола и олефинов проникают внутрь зёрен, где у активных центров (сульфогрупп) протекает алкилирование. Сульфокатионит в отсутствие полярного растворителя (например, воды) не способен протонировать молекулы олефинов, а следовательно, не может катализировать реакцию алкилирования. В нашем случае среда безводная, однако роль полярного растворителя здесь играет фенол. Молекулы фенола абсорбируются катионитом, и внутри зёрен последнего происходит обмен протонами между SO3H-группой этого катионита и ОН-группой фенола. Именно этот обмен протонами и делает возможным протонирование молекул олефинов, а следовательно и протекание реакции алкилирования на сульфокатионите. Поскольку катионит лучше сорбирует фенол, чем олефины, то внутри зёрен создаётся избыток фенола, что обуславливает образование преимущественно моноалкилфенолов.Количество функциональных групп на поверхности катионита ничтожно мало, в связи с этим ионно-каталитические процессы происходят, главным образом, внутри гранул, чему способствует набухание смол в реагирующих компонентах. Повышение температуры увеличивает скорость алкилирования, что связано с ростом скорости диффузии реагентов внутрь гранул катионитов и увеличением подвижности протонов сульфогрупп. Так, при повышении температуры от 95 до 130 ºС скорость алкилирования увеличивается в 4 раза. Показано, что при повышении температуры от 130 до 150 ºС выход алкилфенолов увеличивается от 64 до 81% с повышением содержания дизамещённых. Количество последних зависит от соотношения фенола и олефинов: с повышением доли фенола образование диалкилпроизводных снижается. Продолжительность контакта реакционной смеси с катионитом определяет глубину превращения. Алкилирование проводят при температуре 120-140 ºС и мольном соотношении реагентов фенол: олефины 1,5÷2 к 1. Перед проведением реакции фенол и олефины должны быть тщательно обезвожены. Это необходимо потому, что при температуре 120-140 ºС вода гидролизует катионит с образованием серной кислоты.
Химизм процесса.
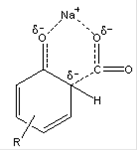
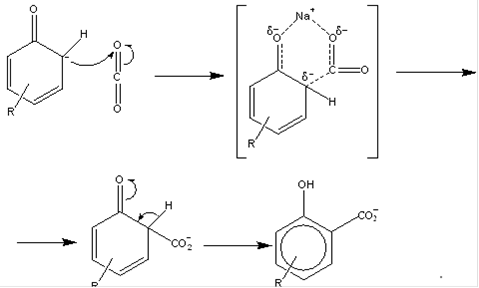
Процесс проводится при температуре 100-125 ºС в реакторе с мешалкой. Используется 42%-ный водный раствор щёлочи. Обезвоживание полученного алкилфенолята натрия осуществляют в двух роторных плёночных испарителях, в которые подаётся азот (первая ступень обезвоживания), а затем в циркуляционных плёночных реакторах, соединённых последовательно (вторая ступень обезвоживания). Отпаривание влаги идёт при t=160 ºС и атмосферном давлении в токе азота, который подаётся в нижнюю часть реактора. Полное обезвоживание достигается благодаря многократной циркуляции алкилфенолята в каждом из реакторов. 3. Получение алкилсалицилата натрия. Алкилсалицилат натрия получают карбоксилированием алкилфенолята натрия диоксидом углерода (реакция Кольбе-Шмидта). Химизм процесса. Продуктом целевой реакции Кольбе-Шмидта является в основном алкил-о-гидроксибензоат (алкилсалицилат) натрия, образуются лишь следы пара-изомера. Однако если реакцию проводить с алкилфенолятом калия, то основным продуктом является алкил-п-гидроксибензоат. Поэтому в нашем производстве использование алкилфенолята калия недопустимо. Предполагают, что преимущественное образование алкил-о-гидроксибензоата при использовании алкилфенолята натрия связано с тем, что образующееся в результате атаки орто-положения переходное состояние стабилизировано в результате образования хелатного соединения в виде ионной пары (см. ниже):
Размеры катиона К+ больше, и, вероятно, он менее эффективен в качестве хелатирующего агента, так что атака пара-положения становится поэтому более предпочтительной [47]. Способность алкилфенолята натрия образовывать хелаты (σ-комплексы) с полярными соединениями (СО2, Н2О, ацетон) обуславливает наличие в его молекуле группы -ONa. Реакция образования хелата экзотермическая, её тепловой эффект равен 17,0 ккал/моль. Так, при взаимодействии с СО2 при 20 ºС температура алкил(С9-С20)фенолята натрия повышается на 20 ºС. При взаимодействии с СО2 фенолята натрия выделяется тепло, равное 18,2 ккал/моль.Именно способность образовывать хелаты вызывает необходимость максимального обезвоживания алкилфенолята. Влага прочно удерживается из-за замыкания в кольцо координационными связями концевых атомов воды. Образование таких структур препятствует протеканию реакции Кольбе-Шмидта, потому что хелат алкилфенолята с водой более прочен, чем с СО2. В итоге вода не даёт части молекул алкилфенолята вступить в реакцию, благодаря чему снижается степень превращения его в алкилсалицилат и выход последнего. По этой же причине снижается выход алкилсалициловых кислот при карбоксилировании в полярных растворителях. Ацетон, например, способен количественно вытеснить СО2 из хелатов фенолята и алкилфенолята натрия. Летучие неполярные растворители снижают выход незначительно из-за снижения парциального давления СО2 в системе. Нелетучие неполярные растворители, снижая вязкость алкилфенолята натрия, способствуют увеличению степени превращения последнего в алкилсалицилат. Природа растворителя оказывает значительное влияние на процесс карбоксилирования незамещённых фенолятов натрия. Для высших алкилфенолятов это влияние выражено не столь резко. Отмечается, что в присутствии карбоната кальция реакцию между фенолом и двуокисью углерода проводят в присутствии воды. Наиболее оптимальные условия проведения реакции Кольбе-Шмидта для алкилфенолятов натрия таковы: температура 130 ºС, давление 0,5-2 МПа, продолжительность реакции - не менее 4 ч. При этих условиях наблюдается минимальное образование побочных продуктов при выходе алкилсалицилата натрия 60-75% от теории. Чем выше температура реакции, тем выше должно быть давление СО2. В промышленности процесс карбоксилирования алкилфенолята натрия обычно проводят периодически в последовательно соединённых герметичных реакторах с интенсивным перемешивающим устройством. В рубашки реакторов предусмотрена подача воды для охлаждения. Описана непрерывная схема карбоксилирования в насадочной колонне с последующей выдержкой карбоксилируемой смеси в пустотелой горизонтальной ёмкости с рубашкой для обогрева. Целевая реакция:
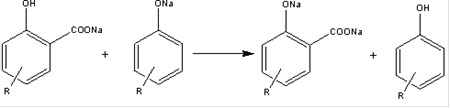
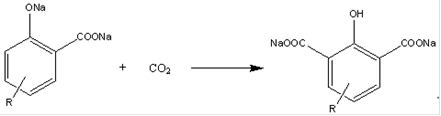
Побочные реакции:
Механизм целевой реакции [47]:
Примечание. При протекании целевой реакции СО2 действует как электрофил, атакуя фенолят натрия. Химизм процесса.
В реальных условиях разложение алкилсалицилата натрия (далее АСН) осуществляют в герметическом реакторе с интенсивным перемешивающим устройством. В этот реактор подаётся АСН и вода в соотношении АСН: Н2О = 1: 4 и при tº=70-90 ºС происходит перемешивание. Образующийся "раствор" АСН и 27-36%-ная водная соляная кислота насосом подаются в последовательно работающие колонны, где идёт разделение водного и органического слоёв. После карбоксилирования переход к алкилсалициловым кислотам можно осуществить также обработкой карбоксилата катионообменной смолой в Н-форме с содержанием воды в пределах 10-50% масс. при температуре 40-90 ºС. Для ускорения процесса обработку катионитом можно вести в присутствии бензина. Н-форму катионита предложено восстанавливать электрохимическим способом. 5. Получение алкилсалицилата кальция (присадки Детерсол-50). Получение присадки Детерсол-50 осуществляют взаимодействием алкилсалициловых кислот с суспензией гидроксида кальция в масле АС-6 при температуре 75-85 ºС в течение 60-90 мин при атмосферном давлении. Процесс проводится периодически в реакторе с перемешивающим устройством. После проведения процесса суспензия разбавляется бензином-растворителем для снижения вязкости.
Химизм процесса.
Химизм процесса.
Карбонатация осуществляется непрерывно в реакторе с гребным винтом. В низ реактора карбонатации подаются алкилсалициловые кислоты в виде раствора в бензине и суспензия гидроксида кальция в масле. Сюда же насосом подаётся метанол, который является промотором реакции, вода и СО2. Температура реакции 40-50 ºС, давление 0,3 атм, продолжительность - 40-60 мин. Отгон метанола и азеотропом с ним - части реакционной воды производится непрерывно в испарителе при температуре 50-60 ºС и остаточном давлении 100-250 мм. рт. ст. После этого для снижения вязкости в суспензию добавляется бензин-растворитель. Процесс карбонатации может осуществляться также и периодически в реакторах с мешалкой. Определение состава алкилсалицилатных присадок. Предложено [48] содержание активного металлсодержащего компонента алкилсалицилатных присадок определять методом диализа. Этим методом определено, что присадка АСК содержит металлсодержащего компонента 41,6%, присадка МАСК - 38,5%, присадка АСБ - 35,9%.Однако этот метод имеет малую точность. В связи с этим состав алкилсалицилатов предложено [49,50] определять с помощью жидкостной хроматографии. В процессе жидкостного хроматографического разделения неорганическая часть присадки остаётся на адсорбенте, а элюируются с адсорбента минеральное масло, свободные алкилфенолы и "нейтральные" соли алкилсалициловых кислот. Данный метод нашёл широкое применение при контроле качества товарных алкилсалицилатных присадок. Техническими требованиями установлены нормы на содержание в этих присадках свободных алкилфенолов (не более 20% масс.) и "нейтральных" алкилсалицилатов (активного вещества не менее 25% масс.).Методом зонного электрофореза можно установить наличие в средне- или высокощелочной алкилсалицилатной присадке алкилфенолятов металлов [51]. В этом методе учитывается величина разделения при тонкослойном электрофорезе, основанном на буферных системах (этанол-вода-борная кислота-ацетат натрия) в сочетании с хроматографией. Предложено диализ сочетать с методами жидкостной [52] и тонкослойной хроматографии [53]. Последний вариант позволяет качественно установить наличие алкилсалицилатов, которые при проявлении окрашиваются в тёмно-голубой флюоресцирующий цвет, и алкилфенолятов, окрашивающихся в чёрный цвет.
Экспериментальная часть Таблица 4.
Сходимость проб = ((64,576% - 63,821%)/64,576%)*100% = (0,755%/64,576%)*100% = 1,1692%.
Среднее по результатам двух параллельных опытов содержание алкилсалициловых кислот в исходном образце = (63,821% + 64,576%)/2 = 64,199%. Опыт 2. Получение присадки Детерсол-50. В литровый трёхгорлый реактор с механической мешалкой, термометром и обратным холодильником загружаем известь-пушонку, раствор алкилсалициловых кислот в бензине, предварительно разбавленный маслом М-6. Включаем перемешивание и нагрев. Нагреваем реакционную массу до tº=75-85ºC и перемешиваем при этой температуре в течение 60-90 мин. По мере перемешивания реакционная смесь темнеет, что свидетельствует о протекании реакции. После окончания срока перемешивания реакционной смеси дают остыть, а затем с целью очистки от непрореагировавшей пушонки её центрифугируют. После этого от реакционной смеси отгоняют бензин. Делают это либо на роторном испарителе, либо на приборе с одногорлым реактором, термометром и прямым холодильником. Во втором случае отгон ведём до температуры 150ºC (именно при этой температуре бензин отгоняется полностью). После завершения отгона бензина получаем товарный Детерсол-50 в виде тёмной вязкой жидкости. Загрузка. Известь-пушонка 5,6 г. Раствор алкилсалициловых кислот в бензине 163,9 г. Масло М-6 73,1 г. Расчёт массы масла М-6, необходимой для разбавления раствора алкилсалициловых кислот в бензине. Обозначим алкилсалициловые кислоты как АСК. На 100 г товарных АСК необходимо загрузить 5,6 г Са(ОН)2. Используемый раствор АСК в бензине содержит 39% масс. бензина и 61% масс. товарных АСК. Составляем пропорцию. В 100 г раствора - 61 г товарных АСК. В х г раствора - 100 г товарных АСК. Отсюда х = (100 г * 100 г)/61 г = 163,9 г. Значит, в реактор необходимо загрузить 163,9 г раствора АСК в бензине. Масса бензина в этом растворе равна (163,9 г - 100 г) = 63,9 г. Используемые товарные АСК имеют кислотное число, равное 103,85. Для получения Детерсола-50 кислотное число (далее КЧ) АСК необходимо снизить до значений 50-60. Для этого добавляют масло М-6. Рассчитаем необходимое количество масла. Разбавляем до КЧ = 60. Пусть G - это общий вес раствора без учёта растворителя. = (Старое КЧ * масса чистых АСК в растворе) / Новое КЧ = (103,85 * 100 г)/60 = 173,1 г.
Тогда общий вес раствора с учётом растворителя будет равен + масса бензина в растворе) = (173,1 г + 63,9 г) = 237 г.
Масса масла М-6 равна
(G - масса товарных АСК в растворе) = (173,1 г - 100 г) = 73,1 г.
Значит, в реактор необходимо загрузить 73,1 г масла М-6. Опыт 3. Получение присадки Детерсол-140. В четырёхгорлый реактор с механической мешалкой, термометром и обратным холодильником загружаем сначала известь-пушонку, затем раствор АСК в масле М-6. После этого приливаем в реактор метанол (промотор реакции), затем воду, затем бензин (растворитель). Включаем перемешивание и нагрев, доводим температуру реакционной смеси до 63-64 ºС. Откручиваем вентиль подачи СО2, не подсоединяя барботёр 2 к реактору, и таким образом продуваем реакционную систему в течение нескольких минут. Это необходимо для того, чтобы перед началом процесса СО2 полностью вытеснил весь воздух из реактора. Установлено, что неполное вытеснение воздуха впоследствии приводит к значительному уменьшению скорости поглощения СО2, а значит и скорости карбонатации. Затем подсоединяем барботёр 2 к реактору, начиная тем самым наш процесс. Баллон с СО2 подсоединён к реактору через барботёр 1. Реактор соединён с атмосферой через барботёр 2. Пробулькивание пузырьков в барботёре 1 свидетельствует о поступлении СО2 в реакционную систему, а отсутствие пробулькивания в барботёре 2 - о том, что весь СО2, поступающий в реактор, поглощается реакционной массой и не уходит в атмосферу. То есть пробулькивание в барботёре 1 и отсутствие пузырьков в барботёре 2 свидетельствует о нормальном протекании процесса карбонатации. Процесс карбонатации проводится до тех пор, пока реакционной системой не поглотится нужный объём углекислого газа. Контроль расхода СО2 производится по манометру с использованием тарировочного графика. При этом мы следим за тем, чтобы процесс протекал нормально. По мере продувания СО2 реакционная смесь темнеет, что свидетельствует о протекании карбонатации. После поглощения системой нужного объёма углекислого газа (обычно на это уходит 1-1,5 часа) вентиль подачи СО2 закручиваем, останавливая тем самым карбонатацию. После этого отгоняем от реакционной смеси метанол, воду и частично бензин. Делаем это либо на роторном испарителе, либо на приборе с одногорлым реактором и прямым холодильником. Полученный отгон состоит из двух слоёв: верхний - бензин, нижний - раствор воды в метаноле. Отгонку продолжаем до тех пор, пока нижний слой не перестанет увеличиваться при добавлении в систему небольшого количества чистого бензина и последующем отгоне этого количества. То есть отгоняем до тех пор, пока не отгоним всю воду. После завершения отгонки реакционную смесь центрифугируем, чтобы очистить её от непрореагировавшей пушонки. После этого отгоняем из смеси бензин, получая товарную присадку Детерсол-140 в виде чёрной вязкой жидкости. Примечание. В данной методике в качестве растворителя вместо бензина может использоваться гептан. Применять в качестве растворителя ксилол, как рекомендовалось ранее [46], нецелесообразно, потому что он образует трудноразделяемую смесь ксилол-метанол-вода. Загрузка. АСК в масле М-6 100 г (60 г товарных АСК, 40 г масла М-6). Са(ОН)2 20 г. СН3ОН 20 г. Н2О 2,5 г. СО2 5 г. Бензин 60 г. Опыт 4. Таблица 5.
Таблица 6.
* - Не нормируется. Определение обязательно.
Обсуждение результатов. Процесс получения присадки Детерсол-50 проводился в безводной среде бензина и масла. Это позволило нам избежать образования не растворимого в воде циклического алкилсалицилата кальция. Данное соединение образуется при взаимодействии алкилсалициловой кислоты с Са(ОН)2 в водной среде:
Благодаря тому, что мы проводили реакцию между исходными реагентами в отсутствии воды, у нас вместо циклического алкилсалицилата кальция образовался целевой продукт - Детерсол-50. Таким образом, при взаимодействии алкилсалициловых кислот с гидроксидом кальция в водной и в безводной средах образуются разные соли. Причиной этого является влияние полярности растворителя, то есть способности растворителя ионизировать растворённые в нём кислоты, основания, соли. Вода имеет высокую полярность, а органическая среда (в данном случае бензин с маслом) - невысокую. Поэтому в водной среде достаточно подвижным для отщепления в виде протона является атом водорода не только карбоксильной группы, но и ОН-группы, связанной с ароматическим кольцом. Поэтому оба этих атома водорода участвуют в солеобразовании, вследствие чего и образуется циклическая соль (реакция (8)). А в органической среде достаточно подвижным для отщепления в виде протона является атом водорода только карбоксильной группы. Атом водорода ОН-группы, связанной с ароматическим кольцом, подвижен недостаточно, и отщепляться в виде протона не может. Поэтому в солеобразовании в данном случае участвует только один атом водорода (карбоксильной группы), вследствие чего образуется Детерсол-50 (реакция (7)). По этой же причине в реакцию с Са(ОН)2 не вступает свободный алкилфенол, содержащийся в технических алкилсалициловых кислотах (он является продуктом одной из побочных реакций карбоксилирования алкилфенолята натрия). В итоге присадка Детерсол-50 содержит кроме продукта реакции (7), ещё и побочные продукты: алкилфенол, углеводороды (также содержащиеся в технических алкилсалициловых кислотах (см. выше)) и масло-растворитель (см. опыт 2). Точно такие же побочные продукты содержатся в Детерсоле-140 и в Детерсоле-180. При получении зольных моющих присадок Детерсол-140 и Детерсол-180 коллоидный раствор образуется в результате химической реакции, при которой два вещества - гидроксид кальция и углекислый газ, растворимых в данной среде (вода), образуют третье вещество - карбонат кальция - практически в ней не растворимое. Таким образом вода в реактор карбонатации загружается для того, чтобы образовался карбонат кальция:
Нерастворимые молекулы СаСО3 образуют ядро коллоидной частицы (мицеллы), которое не растворимо в дисперсионной среде - воде. Образовавшееся ядро коллоидной степени дисперсности является носителем свободной энергии, поэтому на его поверхности идёт адсорбционный процесс. Согласно правилу "Пескова-Фаянса" на поверхности ядра мицеллы обычно адсорбируются ионы, имеющиеся в составе ядра мицеллы. Поскольку ядро частицы состоит из молекул СаСО3, то такими ионами могут быть Са2+ или СО32 - .
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-03-26; просмотров: 250; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.15.235.104 (0.118 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||




 Выделившаяся серная кислота катализирует гомогенное алкилирование, что приводит к снижению селективности процесса и образованию кроме целевых моноалкилфенолов ещё и побочных продуктов: ди- и триалкилфенолов. Поэтому гидролиз катионита нежелателен и реагенты должны быть максимально обезвожены. 2. Получение алкилфенолята натрия. Алкилфенолят натрия получают взаимодействием алкилфенола с гидроксидом натрия. Как и всякая реакция нейтрализации, эта реакция сопровождается выделением небольшого количества тепла (до 2,4 ккал/моль).
Выделившаяся серная кислота катализирует гомогенное алкилирование, что приводит к снижению селективности процесса и образованию кроме целевых моноалкилфенолов ещё и побочных продуктов: ди- и триалкилфенолов. Поэтому гидролиз катионита нежелателен и реагенты должны быть максимально обезвожены. 2. Получение алкилфенолята натрия. Алкилфенолят натрия получают взаимодействием алкилфенола с гидроксидом натрия. Как и всякая реакция нейтрализации, эта реакция сопровождается выделением небольшого количества тепла (до 2,4 ккал/моль).