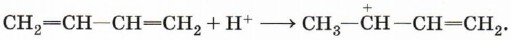Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Особенности строения и свойств сопряженных алкадиенов. Реакции присоединения, полимеризации.
Алкадиены (диены, диеновые углеводороды) – соединения, в молекулах которых присутствуют две двойные связи. Общая формула CnH2n-2. Сопряженные диены – соединения, в молекулах которых две двойные связи разделены одной простой связью: СН2=СН–СН=СН–СН3 (пентадиен-1,3)
Изолированные диены – соединения, в молекулах которых две двойные связи разделены более чем одной простой связью. СН2=СН–СН2–СН=СН2 (пентадиен-1,4)
Рассмотрим строение сопряженного алкадиена бутадиена-1,3. Молекула имеет плоское строение. Рис. 1. Все 4 атома С в sp2-гибридизации, 2 двойных связи. Однако длина этих двойных связей (0,135 нм) больше, чем у алкена (0,133 нм), а простая связь между атомами углерода (0,146 нм) короче, чем связь С-С в алканах (0,154 нм).
Две сопряженных двойных связи в химических реакциях часто ведут себя, как единое целое. Почему?
Происходит частичное перекрывание π-электронных облаков между 2-м и 3-м атомами углерода, и четыре р-орбитали образуют единое π-электронное облако. Такой тип перекрывания орбиталей называют сопряжением. Четыре электрона не локализованы попарно на двойных связях, а распределены вдоль всей цепи – делокализованы. Рис. 2.
Типичные реакции – электрофильное присоединение.
Реакция с избытком брома:
СН2=CН–СH=СН2 + 2Вr2 ——® СН2Вr–CHВr–СHBr-СН2Br
При взаимодействии 1:1 образуется смесь.
Обычное присоединение:
СН2=CН–СH=СН2 + Вr2 ——® СН2Вr–CHВr–СH=СН2
Сопряженное присоединение:
СН2=CН–СH=СН2 + Вr2 ——® СН2Вr–СН=CH–СН2Вr
При сопряженном присоединении π-электронное облако диена участвует в реакции присоединения как единое целое.
1. В промышленности бутадиен-1,3 и изопрен получают каталитическим дегидрированием бутана и 2-метилбутана, выделенных из фракций нефтеперегонки:
2. Бутадиен-1,3 в промышленности получают из этилового спирта по методу С.В.Лебедева:
3. Лабораторный способ – реакции отщепления, например:
СН2Br-СН2-СН2-СН2Br + 2КОН ® СН2=СН-СН=СН2 + 2KBr + 2H2O
В промышленности диены используют для получения синтетического каучука. Углеводороды, содержащие две и более двойные связи в молекуле – терпены – широко распространены в растительных организмах, часто обладают приятным запахом. Смеси терпенов используют в производстве духов и ароматических отдушек, а также в медицине.
Жизненно важен для человека b-каротин, который превращается в организме в витамин А, он содержится в красных и желтых плодах. Рис. 3. Красный цвет b-каротина обусловлен длинной цепочкой сопряженных двойных связей. Реакции полимеризации. Важнейшим свойством диенов является способность полимеризоваться под воздействием катионов или свободных радикалов. Полимеризация этих соединений является основой получения синтетических каучуков:
Полимеризация сопряжённых алкадиенов протекает как 1,4-присоединение. В этом случае двойная связь оказывается центральной в элементарном звене, а элементарное звено, в свою очередь, может принимать как цис-, так и транс-конфигурацию:
Реакции присоединения. Алкадиены способны присоединять водород, галогены, галогеноводороды. Особенностью алкадиенов с сопряжёнными двойными связями является способность присоединять молекулы как в положения 1 и 2 (1,2-присоединение), так и в положения 1 и 4 (1,4-присоединение):
Рассмотрим причины, по которым в случае алкадиенов с сопряжёнными двойными связями возможно 1,4-присоединение на примере реакции гидробромирования (присоединения НВr). Реакция протекает по механизму электрофильного присоединения и начинаетс я с присоединения электрофильной частицы, катиона водорода, к молекуле алкадиена:
Присоединение к этому карбокатиону иона Вr- приведёт к продукту 1,2-присоединения:
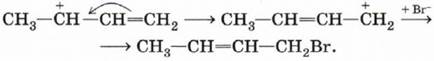
Положительный заряд на атоме углерода означает наличие незаполненной р-орбитали, которая может перекрываться с π-связью, перетягивая к себе электронную плотность. В результате этого происходит перемещение двойной связи в центр молекулы, а положительный заряд оказывается на крайнем атоме углерода. Присоединение к нему аниона брома приведёт к продукту 1,4-присоединения:
|
|||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 2092; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.249.105 (0.005 с.) |
 Рис. 1. Сопряжение орбиталей в бутадиене 1,3
Рис. 1. Сопряжение орбиталей в бутадиене 1,3 Рис. 2. Шаростержневая модель молекулы бутадиена-1,3
Рис. 2. Шаростержневая модель молекулы бутадиена-1,3