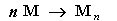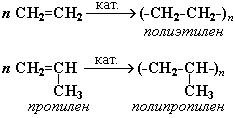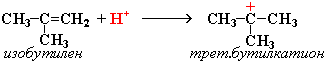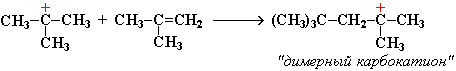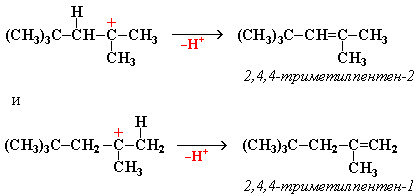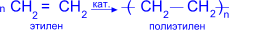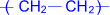Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ионная связь. Металлическая связь.Стр 1 из 10Следующая ⇒
Ионная связь. Металлическая связь. Ионная связь. Ионные кристаллы Химическая связь может возникнуть при электростатическом притяжении двух разноименных ионов - катиона и аниона, например, K+ и I−. Перекрывание атомных орбиталей в этом случае незначительно, и электронная плотность распределена неравномерно, недостаток её будет у атома калия, а избыток - у атома иода. Ионную связь (K+)−(I−) рассматривают как предельный случай ковалентной связи. кристаллическая решетка иодида калия Общая пара электронов в случае ионной связи практически полностью смещена к аниону. Обычно это происходит в соединениях элементов с большой разностью электроотрицательности (например, в соединениях CsF, NaBr, K2O, Rb2S, Li3N и др.). Все эти соединения при обычных условиях представляют собой ионные кристаллы (кристаллы, построенные из катионов и анионов), например кристаллы иодида калия или хлорида натрия.
Металлическая связь. Металлические кристаллы В металлах валентные электроны удерживаются атомами крайне слабо и способны мигрировать. Атомы, оставшиеся без внешних электронов, приобретают положительный заряд. Они образуют металлическую кристаллическую решётку. Совокупность обобществлённых валентных электронов (электронный газ), заряженных отрицательно, удерживает положительные ионы металла в определённых точках пространства - узлах кристаллической решётки, например, металла серебро. Внешние электроны могут свободно и хаотично перемещаться, поэтому металлы характеризуются высокой электропроводностью (особенно золото, серебро, медь, алюминий). Классификация реакций в соответствии с видом переносимых частиц. Окислительно-восстановительные реакции. Окислитель и восстановитель. Сопряженные окислительно-восстановительные пары. Примеры реакций, в которых 3 элемента меняют заряд. Окислительно-восстановительные реакции - это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. Окисление - процесс отдачи электронов, с увеличением степени окисления. При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов. В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле. Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель:
окислитель + e− ↔ сопряжённый восстановитель. Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается. При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др. Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель: восстановитель — e− ↔ сопряжённый окислитель. Несвязанный, свободный электрон является сильнейшим восстановителем. Виды окислительно-восстановительных реакций Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например: Н2S + Cl2 → S + 2HCl Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например: 2H2O → 2H2 + O2 Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например: Cl2 + H2O → HClO + HCl Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например: NH4NO3 → N2O + 2H2O
11. Типы окислительно-восстановительных реакций. Направление окислительно-восстановительных реакций. Роль окислительно-восстановительных реакций в жизненных процессах.
Типы окислительно-восстановительных реакций
1. Межмолекулярные – изменяются С.О. атомов элементов, входящих в состав разных веществ:
2. Внутримолекулярные – окислитель и восстановитель - атомы одной молекулы:
tº
3. Самоокисления – самовосстановления (диспропорционирования) – один и тот же элемент повышает и понижает С.О.
Cl2 - является окислителем и восстановителем.
8.3. Направление окислительно-восстановительных реакций
О направлении ОВР можно судить по изменению энергии Гиббса ∆G. Если ∆G < 0 – реакция возможна, если ∆G > 0 - невозможна. Из термодинамики известно, что ∆G = -n·F·E; E = φок-ля -φв-ля или φок-ля > φв-ля, что возможно при Е > 0 и ∆G < 0.
Рассмотрим реакцию:
.
Она состоит из двух полуреакций:
.
Т.к. φок-ля > φв-ля, то возможно самопроизвольное протекание реакции слева направо.
2FeCl3 + 2KJ → 2FeCl2 + J2 + 2KCl
Из всех возможных при данных условиях О.В.Р. в первую очередь протекает та, которая имеет наибольшую разность окислительно – восстановительных потенциалов.
О.В.Р. протекают в сторону образования более слабых окислителей и восстановителей из более сильных.
Роль окислительно-восстановительных процессов. О.В.Р. играют важную роль в природе и технике. О.В.Р. – это процессы фотосинтеза у растений, процессы дыхания у животных и человека, процессы горения топлива. Иногда О.В.Р. наносят ущерб природе и человеку, например, при коррозии металлов, лесных пожарах, образовании токсичных диоксинов.
При помощи О.В.Р. получают металлы, органические и неорганические соединения, проводят анализ различных веществ, очищают природные и сточные воды, газовые выбросы.
Состав, строение и виды изомерии у этиленовых углеводородов. Физические свойства. Реакции полимеризации; механизмы реакции полимеризации. Окисление кислородсодержащими окислителями и биологическое окисление. Алкены – предельные углеводороды с формулойCnH2n Полимеризация. Полимеризация – реакция образования высокомолекулярного соединения (полимера) путем последовательного присоединения молекул низкомолекулярного вещества (мономера) по схеме:
Число n называется степенью полимеризации. Реакции полимеризации алкенов идут в результате присоединения по кратным связям:
Димеризация алкенов – образование димера (удвоенной молекулы) в результате реакции присоединения. В присутствии минеральной кислоты (донора протона Н+) происходит присоединение протона по двойной связи молекулы алкена. При этом образуется карбокатион:
Этот карбокатион присоединяется к следующей молекуле алкена с образованием "димерного карбокатиона":
"Димерный карбокатион" стабилизируется путем выброса протона, что приводит к продуктам димеризации алкена – смеси изомерных диизобутиленов (2,4,4-триметипентена-2 и 2,4,4-триметилпентена-1):
Этот процесс протекает при обработке изобутилена (2-метипропена) 60% серной кислотой при температуре 70°С. Образовавшаяся в результате смесь диизобутиленов подвергается гидрированию с целью получения "изооктана" (2,2,4-триметилпентана), который применяется для улучшения антидетонационной способности бензина ("изооктан" – стандарт моторного топлива с октановым числом 100).
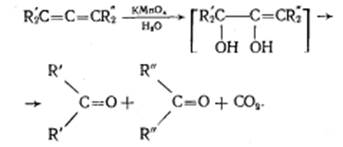
Подобно реакции димеризации алкенов происходит их полимеризация, только процесс не останавливается на стадии образования димера, а идет дальше и включает в себя множество стадий присоединения молекул алкена к растущему карбокатиону. Реакции окисления: Кумулированные диены легко окисляются водным раствором перманганата калия в нейтральной или слабощелочной среде, а также раствор перманганата калия в уксусной кислоте или пиридине вызывают расщепление до карбонильных соединений.
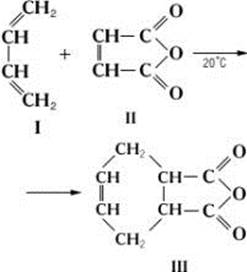
Реакцию димеризации диенов можно рассматривать как частный случай диенового синтеза – соединение 2-х молекул в одну (димер) Диеновый синтез, реакция 1,4-присоединения диеновых углеводородов с сопряжёнными двойными связями (диенов) к ненасыщенным соединениям (диенофилам). В результате Диеновый синтез образуются шестичленные циклы, содержащие двойную связь между вторым и третьим атомами углерода исходного диена. Типичный пример Диеновый синтез — получение ангидрида тетрагидрофталевой кислоты (III) из бутадиена-1,3 (I) и малеинового ангидрида (II):
Диенофилами обычно служат соединения, содержащие этиленовую или ацетиленовую связь, активированную электроотрицательной группой (— CO —, — COOR, — CN, — NO2 или др.). С такими диенофилами Диеновый синтезосуществляют простым смешением или нагреванием реагентов при 100—120°С. При отсутствии активирующей группы в диенофиле для Диеновый синтез необходимы жёсткие условия. В качестве диенофилов можно применять также карбонильные соединения, например гексафторацетон (CF3)2C = О, нитрозосоединения, например нитрозобензол C6H5— N = О, азосоединения, например гексафторазометан CF3 — N = N — CF3 и др. Роль диенов могут выполнять гетероциклические соединения, например фуран. Диеновый синтез широко применяют в синтетической органической химии, в том числе для синтеза стероидов.
15.Химические свойства алкенов: реакции присоединения:
1) Галогенирование. Алкены обесцвечивают бромную воду: СН2=СН2 + Вr2 → ВrСН2-СН2Вr. Эта реакция является качественной на двойную связь. 2)Гидрирование. Присоединение водорода происходит под действием металлических катализаторов:
3)Гидрогалогенирование. СН3-СН=СН2 + НВr СН3-СНВr-СН3. Продукты реакции определяются правилом Марковникова. 4)Гидратация. При взаимодействии алкенов с водой в присутствии минеральных кислот (серной, фосфорной) образуются спирты. Минеральные кислоты выполняют роль катализаторов и являются источниками протонов. Присоединение воды также идет по правилу Марковникова: СН3-СН=СН2 + НОН → СН3-СН(ОН)-СН3.
Классификация реакций в соответствии с видом переносимых частиц. Окислительно-восстановительные реакции. Окислитель и восстановитель. Сопряженные окислительно-восстановительные пары. Примеры реакций, в которых 3 элемента меняют заряд. Окислительно-восстановительные реакции - это встречно-параллельные химические реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, реализующихся путём перераспределения электронов между атомом-окислителем и атомом-восстановителем. Окисление - процесс отдачи электронов, с увеличением степени окисления. При окисле́нии вещества в результате отдачи электронов увеличивается его степень окисления. Атомы окисляемого вещества называются донорами электронов, а атомы окислителя — акцепторами электронов. В некоторых случаях при окислении молекула исходного вещества может стать нестабильной и распасться на более стабильные и более мелкие составные части (см. Свободные радикалы). При этом некоторые из атомов получившихся молекул имеют более высокую степень окисления, чем те же атомы в исходной молекуле. Окислитель, принимая электроны, приобретает восстановительные свойства, превращаясь в сопряжённый восстановитель: окислитель + e− ↔ сопряжённый восстановитель. Восстановле́нием называется процесс присоединения электронов атомом вещества, при этом его степень окисления понижается. При восстановлении атомы или ионы присоединяют электроны. При этом происходит понижение степени окисления элемента. Примеры: восстановление оксидов металлов до свободных металлов при помощи водорода, углерода, других веществ; восстановление органических кислот в альдегиды и спирты; гидрогенизация жиров и др. Восстановитель, отдавая электроны, приобретает окислительные свойства, превращаясь в сопряжённый окислитель: восстановитель — e− ↔ сопряжённый окислитель. Несвязанный, свободный электрон является сильнейшим восстановителем. Виды окислительно-восстановительных реакций Межмолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например: Н2S + Cl2 → S + 2HCl Внутримолекулярные — реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например: 2H2O → 2H2 + O2 Диспропорционирование (самоокисление-самовосстановление) — реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель, например:
Cl2 + H2O → HClO + HCl Репропорционирование (конпропорционирование) — реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления, например: NH4NO3 → N2O + 2H2O
11. Типы окислительно-восстановительных реакций. Направление окислительно-восстановительных реакций. Роль окислительно-восстановительных реакций в жизненных процессах.
Типы окислительно-восстановительных реакций
1. Межмолекулярные – изменяются С.О. атомов элементов, входящих в состав разных веществ:
2. Внутримолекулярные – окислитель и восстановитель - атомы одной молекулы:
tº
3. Самоокисления – самовосстановления (диспропорционирования) – один и тот же элемент повышает и понижает С.О.
Cl2 - является окислителем и восстановителем.
8.3. Направление окислительно-восстановительных реакций
О направлении ОВР можно судить по изменению энергии Гиббса ∆G. Если ∆G < 0 – реакция возможна, если ∆G > 0 - невозможна. Из термодинамики известно, что ∆G = -n·F·E; E = φок-ля -φв-ля или φок-ля > φв-ля, что возможно при Е > 0 и ∆G < 0.
Рассмотрим реакцию:
.
Она состоит из двух полуреакций:
.
Т.к. φок-ля > φв-ля, то возможно самопроизвольное протекание реакции слева направо.
2FeCl3 + 2KJ → 2FeCl2 + J2 + 2KCl
Из всех возможных при данных условиях О.В.Р. в первую очередь протекает та, которая имеет наибольшую разность окислительно – восстановительных потенциалов.
О.В.Р. протекают в сторону образования более слабых окислителей и восстановителей из более сильных.
Роль окислительно-восстановительных процессов. О.В.Р. играют важную роль в природе и технике. О.В.Р. – это процессы фотосинтеза у растений, процессы дыхания у животных и человека, процессы горения топлива. Иногда О.В.Р. наносят ущерб природе и человеку, например, при коррозии металлов, лесных пожарах, образовании токсичных диоксинов.
При помощи О.В.Р. получают металлы, органические и неорганические соединения, проводят анализ различных веществ, очищают природные и сточные воды, газовые выбросы.
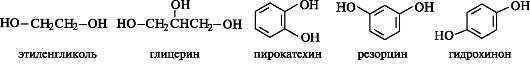
Двухатомные спирты, т.е. спирты, содержащие две гидроксильные группы, имеют общее название диолы, или гликоли; трехатомные спирты называют триолами. Представителями таких спиртов являются этиленгликоль и глицерин соответственно. Общее название многоатомных спиртов – полиолы. В состав многих природных соединений входят в виде фрагментов двухатомные фенолы – пирокатехин, резорцин, гидрохинон.
Этиленгликоль (этандиол-1,2)- Сиропообразная, вязкая бесцветная жидкость, имеет спиртовой запах, хорошо смешивается с водой, сильно понижает температуру замерзания воды (60%-ый раствор замерзает при -49˚С) – это используется в системах охлаждения двигателей – антифризы. Этиленгликоль токсичен – сильный Яд! Угнетает ЦНС и поражает почки. Глицерин (пропантриол-1,2,3)- бесцветная, вязкая сиропообразная жидкость, сладкая на вкус. Не ядовит. Без запаха. Хорошо смешивается с водой. Распространён в живой природе. Играет важную роль в обменных процессах, так как входит в состав жиров (липидов) животных и растительных тканей. Применяется как компонент мазей для смягчения кожи. К спиртам высшей атомности относятся пентиты и гекситы, т.е. соответственно пяти- и шестиатомные спирты с открытой цепью. Накопление гидроксильных групп в молекуле ведет к появлению сладкого вкуса. Представители пентитов и гекситов - ксилит и сорбит - заменители сахара для больных диабетом. Многоатомный циклический спирт инозит относится к витаминоподобным соединениям (витамины группы В) и является структурным компонентом сложных липидов – фосфатидилинозитов. В растениях широко распространена фитиновая кислота, представляющая собой гексафосфат миоинозита. Кальциевая или смешанная кальций-магниевая соль фитиновой кислоты, называемая фитином, улучшает состояние нервной системы при заболеваниях, связанных с недостатком фосфора в организме. В связи с наличием в их молекулах асимметрических центров инозиты существуют в виде нескольких стереоизомеров, из которых наиболее распространен миоинозит. Молекула миоинозита имеет стабильную конформацию кресла, в которой пять из шести групп ОН находятся в экваториальных положениях. Многоатомные спирты, содержащие гидроксильные группы у соседних атомов углерода, при взаимодействии с гидроксидами тяжелых металлов, например гидроксидом меди (II) в щелочной среде, образуют внутрикомплексные, так называемые хелатные, соединения. Такие соединения обычно хорошо растворимы в воде и интенсивно окрашены, поэтому реакция используется как качественная. При взаимодействии этиленгликоля или глицерина с гидроксидом меди (II) возникает интенсивно синее окрашивание в результате образования гликолята меди (II) или глицерата меди (II).
Кислота кислота α-аминокислота α-аминокислота дикетопиперазин (10.7) Лактиды и дикетопиперазины представляют собой соответственно циклические сложные эфиры или амиды; в условиях кислотного или основного катализа они способны к гидролизу, ведущему к исходным α-гидрокси- или α-аминокислотам.
Гетерополисахариды Полисахариды, в структуре которых характерно наличие двух или более типов мономерных звеньев, носят название гетерополисахаридов.Принято считать, что, поскольку гетерополисахариды чаще состоят только из двух различных мономеров, расположенных повторяющимся образом, они не являются информационными молекулами.Важнейшие представители гетерополисахаридов в органах и тканях животных и человека – гликозаминогликаны (мукополисахариды). Они состоят из цепей сложных углеводов, содержащих аминосахара и уроновые кислоты.
Моносахарид Рибоза и 2-дезоксирибоза относятся к моносахаридам, содержащим пять углеродных атомов. В состав нуклеиновых кислот они входят в циклических β-формах:
Остаток фосфорной кислоты ДНК и РНК В зависимости от того, какой моносахарид содержится в структурном звене полинуклеотида - рибоза или 2-дезоксирибоза, различают · рибонуклеиновые кислоты (РНК) и · дезоксирибонуклеиновые кислоты (ДНК) В главную (сахарофосфатную) цепь РНК входят остатки рибозы, а в ДНК – 2-дезоксирибозы. Молекулярная масса ДНК достигает десятков миллионов а.е.м. Это самые длинные из известных макромолекул. Значительно меньше молекулярная масса РНК (от нескольких сотен до десятков тысяч). ДНК содержатся в основном в ядрах клеток, РНК – в рибосомах и протоплазме клеток.При описании строения нуклеиновых кислот учитывают различные уровни организации макромолекул: первичную и вторичную структуру. · Первичная структура нуклеиновых кислот – это нуклеотидный состав и определенная последовательность нуклеотидных звеньев в полимерной цепи. Например: ...– А – Г – Ц –... · Под вторичной структурой нуклеиновых кислот понимают пространственно упорядоченные формы полинуклеотидных цепей. Вторичная структура ДНК представляет собой две параллельные неразветвленные полинуклеотидные цепи, закрученные вокруг общей оси в двойную спираль.Такая пространственная структура удерживается множеством водородных связей, образуемых азотистыми основаниями, направленными внутрь спирали. Водородные связи возникают между пуриновым основанием одной цепи и пиримидиновым основанием другой цепи. Эти основания составляют комплементарные пары (от лат. complementum - дополнение).Образование водородных связей между комплементарными парами оснований обусловлено их пространственным соответствием.
Пиримидиновое основание комплементарно пуриновому основанию:
Водородные связи между другими парами оснований не позволяют им разместиться в структуре двойной спирали. Таким образом, · ТИМИН (Т) комплементарен АДЕНИНУ (А), · ЦИТОЗИН (Ц) комплементарен ГУАНИНУ (Г). Комплементарность оснований определяет комплементарность цепей в молекулах ДНК.
Комплементарность полинуклеотидных цепей служит химической основой главной функции ДНК – хранения и передачи наследственных признаков. Способность ДНК не только хранить, но и использовать генетическую информацию определяется следующими ее свойствами: · молекулы ДНК способны к репликации (удвоению), т.е. могут обеспечить возможность синтеза других молекул ДНК, идентичных исходным, поскольку последовательность оснований в одной из цепей двойной спирали контролирует их расположение в другой цепи. молекулы ДНК могут направлять совершенно точным и определенным образом синтез белков, специфичных для организмов данного вида. Вторичная структура РНК В отличие от ДНК, молекулы РНК состоят из одной полинуклеотидной цепи и не имеют строго определенной пространственной формы (вторичная структура РНК зависит от их биологических функций). Основная роль РНК – непосредственное участие в биосинтезе белка. Известны три вида клеточных РНК, которые отличаются по местоположению в клетке, составу, размерам и свойствам, определяющим их специфическую роль в образовании белковых макромолекул: · информационные (матричные) РНК передают закодированную в ДНК информацию о структуре белка от ядра клетки к рибосомам, где и осуществляется синтез белка; · транспортные РНК собирают аминокислоты в цитоплазме клетки и переносят их в рибосому; молекулы РНК этого типа "узнают" по соответствующим участкам цепи информационной РНК, какие аминокислоты должны участвовать в синтезе белка; · рибосомные РНК обеспечивают синтез белка определенного строения, считывая информацию с информационной (матричной) РНК.
Кислоты и основания Льюиса. Согласно теории Льюиса, кислотно-основные свойства соединений определяются их способностью принимать или отдавать пару электронов с образованием новой связи. Кислоты Льюиса – акцепторы пары электронов, основания Льюиса – доноры пары электронов. Кислотами Льюиса могут быть молекулы, атомы или катионы, обладающие вакантной орбиталью и способные принимать пару электронов с образованием ковалентной связи. К кислотам Льюиса относятся галогениды элементов II и III групп периодической системы, галогениды других металлов, имеющих вакантные орбитали, протон. Кислоты Льюиса в реакциях участвуют в качестве электрофильных реагентов. Основаниями Льюиса являются молекулы, атомы или анионы, имеющие неподеленную пару электронов, которую они предоставляют для образования связи с вакантной орбиталью. К основаниям Льюиса относятся спирты, простые эфиры, амины, тиоспирты, тиоэфиры, а также соединения, имеющие p-связи. В реакциях основания Льюиса проявляют себя как нуклеофильные частицы. Развитие теории Льюиса привело к созданию принципа жестких и мягких кислот и оснований (принцип ЖМКО или принцип Пирсона). Согласно принципа Пирсона, кислоты и основания подразделяются на жесткие и мягкие. Жесткие кислоты – это кислоты Льюиса, донорные атомы которых малы по размеру, обладают большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. К ним относятся: протон, ионы металлов (К+, Na+, Mg2+, Ca2+, Al3+), AlCl3 и др. Мягкие кислоты - – это кислоты Льюиса, донорные атомы которых имеют большие размеры, большую поляризуемость, обладают малым положительным зарядом и низкой электроотрицательностью. К ним относятся: ионы металлов (Ag+, Cu+), галогены (Br2, I2), катионы Br+, I+ и др. Жесткие основания – основания Льюиса, донорные атомы которых обладают высокой электроотрицательностью, низкой поляризуемостью, имеют малый радиус атома. К ним относятся: Н2О, ОН-, F-, Cl-, NO3-, ROH, NH3, RCOO- и др. Мягкие основания -основания Льюиса, донорные атомы которых обладают высокой поляризуемостью, низкой электроотрицательностью, имеют большой радиус атома. К ним относятся: Н-, I-, C2H4, C6H6, RS- и др. Суть принципа ЖМКО состоит в том, что жесткие кислоты реагируют с жесткими основаниями, мягкие кислоты – с мягкими основаниями
14. Состав, строение и виды изомерии у этиленовых углеводородов. Физические свойства. Реакции полимеризации; механизмы реакции полимеризации. Окисление кислородсодержащими окислителями и биологическое окисление.
Состав, строение и виды изомерии у этиленовых углеводородов Алкены, или олефины, этиленовые — непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь. (Слайд 3) Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными. Алкены образуют гомологический ряд с общей формулой CnH2n. Простейшим представителем этиленовых углеводородов, его родоначальником является этилен (этен) С2Н4. Строение его молекулы можно выразить такими формулами: H H H H | |:: C==C C::C | |:: H H H H По названию первого представителя этого ряда такие углеводороды называют этиленовыми. В алкенах атомы углерода находятся во втором валентном состоянии (sр2-гибридизация). (Слайд 4) В этом случае между углеродными атомами возникает двойная связь, состоящая из одной s- и одной p-связи. Длина и энергия двойной связи равны соответственно 0,134 нм и 610 кДж/моль.Все валентные углы НСН близки к 120º. Для алкенов характерны два вида изомерии: структурная и пространственная. (Слайд 5) Виды структурной изомерии: · изомерия углеродного скелета , · изомерия положения двойной связи , · межклассовая изомерия . Геометрическая изомерия — один из видов пространственной изомерии. Изомеры, у которых одинаковые заместители (при разных углеродных атомах) расположены по одну сторону от двойной связи, называют цис-изомерами, а по разную — транс-изомерами: . Физические свойства Реакции полимеризации; механизмы реакции полимеризации. Одной из наиболее важных в практическом отношении реакций непредельных соединений (или олефинов) является полимеризация. Реакцией полимеризации называется процесс образования высокомолекулярного соединения (полимера) путем соединения друг с другом молекул исходного низкомолекулярного соединения (мономера). При полимеризации двойные связи в молекулах исходного непредельного соединения "раскрываются", и за счет образующихся свободных валентностей эти молекулы соединяются друг с другом. В зависимости от механизма реакции полимеризация бывает двух видов:
“Радикальная полимеризация вызывается (инициируется) веществами, способными в условиях проведения реакции распадаться на свободные радикалы - например, пероксидами, а также действием тепла и света. CH2=CH2 ––R ˙ ® R–CH2−CH2• ––C2H4® R−CH2−CH2−CH2−CH2• На начальной стадии радикал-инициатор атакует молекулу этилена, вызывая при этом гомолитическое расщепление двойной связи, присоединяется к одному из атомов углерода и образует новый радикал. Образующийся радикал атакует далее следующую молекулу этилена и по указанному пути приводит к новому радикалу, вызывающему дальнейшие аналогичные превращения исходного соединения.
Ионная или каталитическая полимеризация
Ионная полимеризация (катионная)
CH2=CH2 ––H+® CH3−CH2+ ––C2H4® CH3−CH2−CH2−C+H2 и т.д.
Ионная полимеризация (анионная)
CH2=CH2 ––R–M® [R−CH2−CH2]-M+ ––C2H4® [R−CH2−CH2−CH2−CH2]-M+ и т.д.
Гидропероксид Дальнейший путь окисления называют ав тоокислением, и он лежит в основе пероксидного окисления липидов, содержащих ненасыщенные жирные кислоты, с обра зованием из них карбоновых кислот с более короткой углеводо родной цепью (разд. 20.1). Автоокисление часто бывает причи ной порчи пищевых продуктов при хранении. За счет авто окисления на воздухе высыхают масляные краски, так как под действием кислорода происходит радикальная полимеризация их ненасыщенной масляной основы.
15. Химические свойства алкенов: реакции присоединения:
Галогенирование- Молекулы галогенов в среднем неполярны, однако возможны временные флуктуации, которые приводят к появлению электрофильности у такой молекулы:
|
|||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 364; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.83.150 (0.174 с.) |