
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Сопряженные системы. Виды сопряженияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Локализованные и делокализованные связи. Ковалентная связь может быть локализованной и делокализованной. Локализованной называют связь, электроны которой поделены между двумя ядрами связываемых атомов. Например: СН3-СН3, СН2=СН2 В тех случаях, когда электроны связи поделены более чем между двумя ядрами, говорят о делокализованной связи. Делокализованная связь – это ковалентная связь, молекулярная орбиталь которой охватывает более двух атомов. Важнейшим фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов. Сопряжение имеется в молекулах многих органических соединений (алкадиены, ароматические углеводороды, карбоновые кислоты, мочевина и др.). Система сопряжения может быть открытой или замкнутой и содержать не только атомы углерода, но и гетероатомы: Cl, O, N, S и др.(акролеин, акрилонитрил,пиридин) Открытая система сопряжения Например, простейшим соединением с открытой системой сопряжения, содержащей только атомы углерода является, например, бутадиен-1,3. СН2=СН – СН=СН2 бутадиен-1,3 Все четыре атома углерода в молекуле бутадиена-1,3 находятся в состоянии sp2-гибридизации. Все эти атомы лежат в одной плоскости и составляют σ-скелет молекулы. Рис 5.
Негибридизованные р – орбитали каждого атома углерода расположены перпендикулярно этой плоскости и параллельно друг другу. Это создаёт условия для их взаимного перекрывания. Перекрывание этих орбиталей происходит не только между атомами С-1 и С-2 и С-3 и С-4, но и частично между атомами С-2 и С-3(рис.5б). При перекрывании четырёх рz-орбиталей происходит образование единого π-электронного облака, т.е. сопряжение двух двойных связей.
Этот тип сопряжения называется π, π-сопряжением, т. к взаимодействуют орбитали π-связей. Цепь сопряжения может включать большое число двойных связей. Чем она длиннее, тем больше делокализация π-электронов и тем устойчивее молекула. В сопряженной системе π-электроны уже не принадлежат определённым связям, они делокализованы т. е. равномерно распределены по всей молекуле. Делокализация π-электронов в сопряженной системе сопровождается выделением энергии, которая называется энергией сопряжения. Такие молекулы более устойчивы, чем системы с изолированными двойными связями. Объясняется это тем, что энергия таких молекул ниже. В результате делокализации электронов при образовании сопряженной системы происходит частичное выравнивание длин связей: одинарнаястановится короче,а двойная-длиннее. Второй вид сопряжения- р,π-сопряжение. В р,π-сопряженных системах в образовании сопряжения принимает участие атомы с неподеленной донорной р- электронной парой. Это могут быть: Cl, O, N, S и др. К таким соединениям относятся галогениды, эфиры, ацетамиды, карбкатионы. В молекулах этих соединений осуществляется сопряжение двойной связи с р-орбиталью гетероатома. Делокализованная трехцентровая связь образуется путем перекрывания двух р-орбиталей sp2-гибридизованных атома углерода и одной р-орбиталью гетероатома с парой электронов.
СН2 = СН –:О: – СН3 Винилметиловый эфир
Винилметиловый эфир
π-электроны
N-Н2 р-электроны Ацетамид
H CH 2 =CH- С =:О: акролеин
CH 2 = CH –С N: акрилонитрил Системы с замкнутой цепью сопряжения. Система сопряжения, содержащая только атомы углерода может быть и замкнутой. Это, прежде всего арены и их производные. Первый представитель бензол:
Все атомы углерода в молекуле бензола находятся в sp2-гибридизации. Шесть sp-гибридных облака образуют каркас бензола. Все σ-связи (С – С и С –Н) лежат в одной плоскости. Шесть негидридизованных р-орбиталей расположены перпендикулярно плоскости молекулы и параллельно друг другу. Каждая р-орбиталь в равной степени может перекрываться с двумя соседними р-орбиталями. В результате такого перекрывания возникает единая делокализованная π-система, наибольшая электронная плотность в которой находится над и под плоскостью σ-скелета и охватывает все атомы углерода цикла. π-Электронная плотность равномерно распределена по всей циклической системе. Все связи между атомами углерода имеют одинаковую длину (0,139 нм), промежуточную между длинами одинарной и двойной связей. В гетероциклических ароматических соединениях наблюдается оба вида сопряжения π,π-сопряжение и р,π-сопряжение. Например π,π-Сопряжение в гетероциклических ароматических соединениях характерно для шестичленных гетероциклов. Например, в пиридине и пиримидине
С С
С С
N:
Пиридин
:N С
N:
Пиримидин
π-Связи в этих соединениях делокализованы между С и N атомами. В пятичленных гетероциклических соединениях - пирроле, фуране, тиофене реализуется р,π-сопряжение.
H Пиррол Фуран Тиофен
Ароматичность — это понятие, включающее различные свойства ароматических соединений, ввёл немецкий физик Э. Хюккель (1931). 1. Плоский замкнутый цикл. 2. Все атомы С находятся в sp2 – гибридизации 3. Подчиняется правилу Хюккеля: содержит в кольце (4n +2) р-электронов, гдеn = 0,1,2,3… 4. Содержит единую сопряженную систему,- или р,π-электронов. 6. Устойчивы к действию окислителей. 7. Обладают термодинамической устойчивостью.
Электронные эффекты Индуктивный эффект Молекула органического соединения представляет собой совокупность атомов, связанных в определённом порядке ковалентными связями. При этом связанные атомы могут различаться по величине электроотрицательности (Э.О.). Электроотрицательность – способность атома притягивать электронную плотность другого атома для осуществления химической связи. Чем больше величина Э.О. данного элемента, тем сильнее он притягивает электроны связи. Величины Э.О. были установлены американским химиком Л. Полингом и этот ряд называется шкалой Полинга. Полярность ковалентной связи – это неравномерное распределение электронной плотности между связанными атомами. Наличие полярной связи в молекуле сказывается на состоянии соседних связей. Они испытывают влияние полярной связи, и их электронная плотность также смещается в сторону более Э.О. атома, т. е. происходит передача электронного эффекта. Смещение электронной плотности по цепи σ-связей называется индуктивным эффектом и обозначается I. Индуктивный эффект передаётся по цепи с затуханием, т. к. при образовании σ-связи выделяется большое количество энергии и она плохо поляризуется и поэтому индуктивный эффект проявляется в большей степени на одну, две связи. Направление смещения электронной плотности всех σ-связей обозначают прямыми стрелками→; Например: СH3δ+ < → CH2δ+< → CH2δ+< →Clδ- Э.О.атома Сl > Э.О. атома С СH3δ+<→ CH2δ+< → CH2δ+< →OHδ- Э.О. гидроксильной группы ОН > Э.О. атома С Атом или группа атомов, смещающие электронную плотность σ-связи от атома углерода на себя называются электроноакцепторнымизаместителями и проявляют отрицательный индуктивный эффект (-I- эффект ). Ими являются галогены (Cl, Br, I), OH-, NH2-, COOH, COH, NO2, SO3H и др. Атом или группа атомов, отдающие электронную плотность называются электронодонорными заместителями и проявляют положительный индуктивный эффект (+I- эффект ). +I-эффектпроявляют алифатические углеводородные радикалы, СН3, С2Н5 и др.
Мезомерный эффект. В отличие от несопряженных соединений, в которых электронное влияние заместителей передается по σ-связям (индуктивный эффект), в сопряженных системах в передаче электронного влияния основную роль играют π-электроны делокализованных ковалентных связей. Эффект, проявляющийся в смещении электронной плотности делокализованной (сопряженной) л-системы, называют мезомерным (М-эффект) или эффектом сопряжения. Мезомерный эффект — передача электронного влияния заместителей по сопряженной системе. При этом заместитель сам является участником сопряженной системы. Он может вносить в систему сопряжения π-связь (карбонильная, карбоксильная и другие группы), неподеленную пару электронов гетероатома (галогены, амино- и гидроксигруппы), вакантную или заполненную одним или двумя электронами р-АО. Заместители, повышающие электронную плотность в сопряженной системе, проявляют положительный мезомерный эффект (+М) + М -эффектом обладают заместители, содержащие атомы с неподеленной парой электронов или целым отрицательным зарядом. Эти заместители способны к передаче пары электронов в общую сопряженную систему, т. е. являются электронодонорными. Заместители, понижающие электронную плотность в сопряженной системе, проявляют отрицательный мезомерный эффект (-М). (-М) -эффектом обладают заместители, содержащие двойные связи и положительно заряженные атомы, т. е. электроноакцепторные заместители. Графически смещение электронной плотности обозначается изогнутыми стрелками, начало которых показывает, какие р- или π -электроны смещаются, а конец — связь или атом, к которым они смещаются. В отличие от индуктивного, мезомерный эффект передается по системе сопряженных связей на значительно большее расстояние. В приведенных ниже примерах показано проявление - М - эффекта карбонильной группы в акролеине и бензальдегиде (π,π-сопряжение), а также + М-эффекта аминогруппы в анилине (р,π- сопряжение).
Табл.3 Электронные эффекты заместителей
|
||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 7878; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.012 с.) |

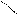


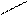 12 34
12 34 
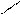
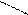


 С С С С
С С С С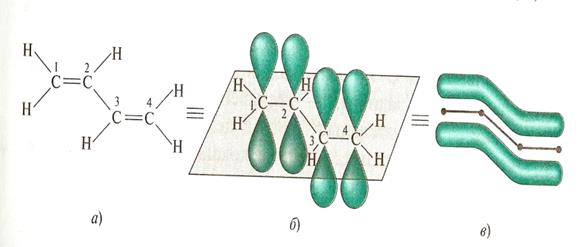 Рис.5 атомно-орбитальная модель бутадиена-1,3
Рис.5 атомно-орбитальная модель бутадиена-1,3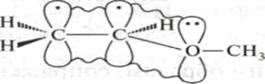
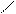
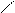 О
О СН3-С ..
СН3-С ..

 С
С

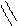

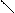
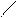
 С
С



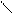
 С С
С С





 Реакционная способность органических веществ в значительной степени зависит от характера действия J и M эффектов. Знание теоретических возможностей действия электронных эффектов позволяет предсказать ход тех или иных химических процессов.
Реакционная способность органических веществ в значительной степени зависит от характера действия J и M эффектов. Знание теоретических возможностей действия электронных эффектов позволяет предсказать ход тех или иных химических процессов.


