Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Атомные орбитали АО. Гибридизация.
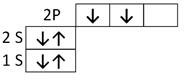
Часть атомного пространства, в котором вероятность нахождения электрона максимальна, называется атомной орбиталью (АО). S -орбиталь имеет сферическую форму, P- орбиталь имеет форму обьемной восьмерки. Электронная конфигурация атома углерода в нормальном (основном) состоянии может быть выражен формулой 1S2 2S2 2P2 или графически:
Таким образом, у атома углерода во втором внешнем электронном слое два спаренных S-электрона и только два неспаренных P-электрона. Следовательно, углерод должен проявлять валентность равную двум, однако он четырехвалентен, т.е. углерод образует четыре ковалентные связи. Четырехвалентность углерода объясняется тем, что атом углерода переходит из основного состояния 1S2 2S2 2P2 в возбужденное состояние 1S2 2S1 2P3 или графически:
Однако, все четыре связи углерода одинаковы. Равноценность всех четырех связей углерода объясняется тем, что происходит смешение орбиталей одного S- и трех P- электронов и называют SP3 - гибридизацией. В результате во внешнем электронном слое углеродного атома возникают четыре одинаковые гибридные связи (несимметричные) восьмёрки. Это первое валентное состояние углерода. Все четыре гибридные облака имеют определенную направленность в пространстве под углом 1090,28. Рис.1
А б в г д Рис.1 негибридизованные 2р (а, б, в) и 2 Sорбитали (г) атома углерода и орбитали атома углерода в состоянии SP3 -гибридизации (д).
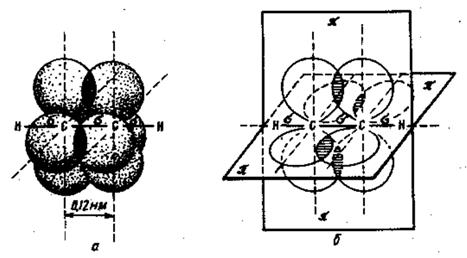
Рис.2 а- перекрывание 1 S-орбиталей атомов водорода (Н-Н); б- перекрывание 1 S-орбитали атома водорода с гибридной орбиталью атома углерода (С-Н); в- перекрывание двух гибридных орбиталей атомов углерода (С-С).
Связи такого типа, в которых максимальное перекрывание электронных облаков осуществляется на линии между центрами атомов называются сигма σ - связями, а электроны участвующие в их образовании сигма σ - электронами. Рис.2
2.5. Ковалентные связи. Г ибридизация.
Ковалентной называется химическая связь, образованная за счёт обобществления электронов связываемых атомов. Ковалентная связь в органической молекуле образуется за счёт перекрывания атомных орбиталей. Существует два типа ковалентной связи: сигма σ и пи πсвязи. σ - Связь образуется за счет перекрывания гибридных SP3-АО.
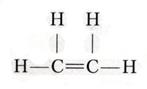
π-Связь образуется при боковом перекрывании негибридизованных P-АО. Г ибридизация орбиталей. SP3 – гибридизация. В результете SP3 –гибридизацииатом углерода переходит из основного состояния 1S2 2S2 2P2 в возбужденное состояние 1S2 2S1 2P3, происходит смешение орбиталей одного 2S- и трех 2P- электронов и его называют SP3 - гибридизацией. В результате во внешнем электронном слое углеродного атома возникают четыре одинаковые гибридные связи. Это первое валентное состояние углерода. Все четыре гибридные облака имеют определенную направленность в пространстве под углом 1090,28. Такое состояние гибридизации характерно для алканов, сигма σ - связи. SP2 – гибридизация. характерна для алкенов. Например, в молекуле этилена Н2С=СН2 при образовании двойной связи в каждом из атомов углерода образуется лишь три гибридные связи за счет гибридизации одной S-орбитали и двух P –орбиталей, SP2 гибридизация у каждого углеродного атома одна из P –орбиталей не участвует в гибридизации и остается неизменной. Связь, которая осуществляется перекрыванием орбиталей P –электронов называется π-связью. Облака этих электронов сохраняют форму объемных восьмерок и направлены перпендикулярно к плоскости, в которой расположены σ -связи молекулы этилена и перекрываются над плоскостью и под этой плоскостью. Второе валентное состояние углерода SP2-гибридизация. В этилене пять сигма σ - связей: четыре С-Н и одна С-С. Все они расположены в одной плоскости, каждая под углом 1200 к соседней связи. Рис.3
Рис.3 Перекрывание двух негибридизованных 2р-орбиталей в молекуле этилена: а- объемное изображение перекрывающихся негибридизованных 2р-орбиталей; б- схематическое изображение этих орбиталей на плоскости.
Двойная связь, являющаяся сочетанием σ - и π-связей, по характеру существенно отличается от простой связи.
Структурная формула этилена SР-гибридизация. Такое состояние гибридизации характерно для алкинов. Рассмотрим на примере ацетилена.
При образовании тройной связи гибридизации подвергаются одна S –орбиталь и одна P –орбиталь. У каждого углеродного атома в ацетилене образуется по две гибридные орбитали, две P –орбитали каждого углеродного атома не участвуют в гибридизации и сохраняют свою конфигурацию в виде двух объемных восьмерок.
Одна из них представляет собой σ -связь, две другие представляют собой π-связи. Рис.4
Рис.4 перекрывание четырех негибридизованных 2 P –орбиталей в молекуле ацетилена: а- объемное изображение четырех перекрывающихся 2 P –орбиталей; б- схематическое изображение этих орбиталей в двух взаимно перпендикулярных плоскостях.
Такая гибридизация называется SP-гибридизацией, третье валентное состояние углерода. Все они расположены в одной плоскости, каждая под углом 1800 к соседней связи. В результате перекрывания орбиталей P –электронов, образуются две π-связи. Эти π-связи расположены в двух взаимно перпендикулярных плоскостях.
|
|||||||
|
Последнее изменение этой страницы: 2017-02-08; просмотров: 740; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.168.172 (0.008 с.) |