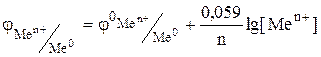Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ряд стандартных электродных потенциалов. Гальванические элементы. Электрохимическая коррозия металлов
Таблица 1 – Индивидуальное задание по разделу
Стандартные электродные потенциалы Задача 2.1: С какими солями в водных растворах реагирует указанный металл (см. табл. 2)?
Таблица 2 – Варианты заданий
Пример решения задачи: Для решения задачи воспользуйтесь значениями стандартных электродных потенциалов (СЭП). Каждый из металлов способен окисляться катионами всех других металлов, для которых величина СЭП (φ0)выше. Непременным условием протекания реакции является соотношение: φокислителя > φвосстановителя. Так, например, металл Zn является восстановителем катионов Fe2+, Ni2+, Cu2+ и др., для которых Zn + FeSO4 = ZnSO4 +Fe Zn – 2e = Zn2+ - окисление Fe2+ + 2e = Fe - восстановление Вычисление электродных потенциалов металлических электродов
Задача 2.2: Вычислить электродный потенциал металлического электрода при заданной активной концентрации (активности) катионов металла (см. табл. 3).
Таблица 3 – Варианты заданий
Пример решения задачи: Электродный потенциал окислительно-восстановительной системы рассчитывается по уравнению Нернста.
где Для металлических электродов при стандартных условиях (Р=101.3 кПа, Т=298 К) уравнение принимает вид:
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 198; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.149.234.141 (0.007 с.) |
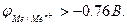
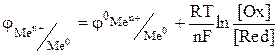
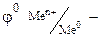 стандартный электродный потенциал металла, В; n – заряд иона металла; [Ox] и [Red] – концентрация окисленной и восстановленной формы ионов металла в растворе его соли, моль/л; R- универсальная газовая постоянная, R=8.31 Дж/моль.К; Т - температура, Т=298 К; F- постоянная Фарадея, F=96500 Кл/моль.
стандартный электродный потенциал металла, В; n – заряд иона металла; [Ox] и [Red] – концентрация окисленной и восстановленной формы ионов металла в растворе его соли, моль/л; R- универсальная газовая постоянная, R=8.31 Дж/моль.К; Т - температура, Т=298 К; F- постоянная Фарадея, F=96500 Кл/моль.