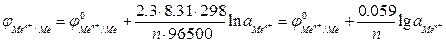Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теоретические аспекты электрохимических процессовСтр 1 из 9Следующая ⇒
Теоретические аспекты электрохимических процессов
Расчет электродного потенциала. Уравнение Нернста
В результате изучения потенциалов различных электродных процессов установлено, что их величины зависят от следующих факторов: 1) от природы веществ – участников электродного процесса; 2) от соотношения между концентрациями этих веществ; 3) от температуры системы. Значения электродных потенциалов рассчитывают по уравнению Нернста:
где Или для металлического электрода
где n – число электронов, теряемых атомом металла при образовании катиона; Для обычной при электрохимических измерениях стандартной температуры (Т = 25ºС или 298 К), при подстановке значений постоянных величин уравнение принимает вид:
Способы защиты от коррозии
Проблему защиты от коррозии нельзя решать, не учитывая связи коррозии с пассивностью. Если коррозия является процессом самопроизвольного растворения металлов, то пассивирование связано с потерей металлом этой способности. Следовательно, для предохранения металла от коррозии необходимо перевести его в пассивное состояние. Некоторые металлы пассивируются в окислительных средах, например железо в концентрированных азотной и серной кислотах. Поэтому эти кислоты хранят в железных цистернах. Железо, никель, кобальт и магний пассивны и в щелочных растворах. Устойчивыми к коррозии являются нержавеющие стали, содержащие кроме железа, хром, никель, марганец и малые добавки титана и ниобия. На изделиях из таких сплавов под действием воздуха и воды возникает химически и механически прочная окисная плёнка, которая полностью пассивирует металл. Если при растворении металла (например, свинца в серной кислоте) образуются нерастворимые продукты, то они, отлагаясь на поверхности, могут тормозить или совсем предотвратить коррозию. Такого рода пассивирование можно назвать механическим.
Действие одних и тех же веществ может, в зависимости от внешних условий и природы металла, и ускорять, и замедлять коррозию. Присутствие в растворе кислорода воздуха часто увеличивает коррозию вследствие электровосстановления кислорода: O2 + 4e + 2H2O = 4OH-, в процессе которого электроны уходят из металла, и ионы последнего переходят в раствор. Если же легко образуется окисная плёнка или при коррозии появляются нерастворимые продукты, то кислород может не ускорять, а замедлять коррозию (например, коррозию алюминия и цинка на воздухе). В нейтральных и щелочных растворах коррозия наблюдается в меньшей степени не только потому, что в этих растворах меньше концентрация иона водорода, но и потому, что в них легче образуются пассивирующие плёнки основного характера. Ионы хлора, брома и йода, как правило, являются депассиваторами нержавеющих сталей и хрома в кислых и нейтральных средах, а никеля и железа – в щелочных. Следовательно, эти ионы способствуют коррозии. В последнее время широкое применение в качестве замедлителей (ингибиторов) коррозии получили различные хорошо адсорбирующиеся вещества, часто органические соединения. Адсорбируясь на поверхности металла, эти вещества могут существенно снижать скорость электрохимических реакций, вызывающих коррозию. Ионы галогенов в кислых растворах способствуют адсорбции ряда органических соединений (преимущественно азотсодержащих органических оснований) на поверхности железа и мягких сталей и, следовательно, усиливают замедляющее действие ингибиторов. Защитный антикоррозионный слой часто создают путём нанесения сплошного слоя устойчивой краски или другого металла. В последнем случае лучшим защитным действием будет обладать менее благородный металл, например железо лучше покрывать цинком, а не медью. Объясняется это тем, что при местных нарушениях покрытия коррозии будет подвергаться наименее благородный металл, так как в месте нарушения сплошной плёнки возникает элемент, в котором электроны переходят от менее благородного металла к более благородному, вследствие чего первый будет растворяться. Это явление широко используют для защиты от коррозии водопроводных труб, паровых котлов и вообще металлических конструкций. Их приводят в соприкосновение с полосами менее благородного металла и тем самым прекращают коррозию основного металла.
В зависимости от характера коррозии и условий ее протекания применяются различные методы защиты. Выбор того или иного способа определяется его эффективностью в данном конкретном случае, а также экономической целесообразностью. Любой метод защиты изменяет ход коррозионного процесса, либо уменьшая скорость, либо прекращая его полностью. Все методы защиты условно делятся на четыре группы: 1. Электрические методы. 2. Методы, связанные с изменением свойств корродирующего металла. 3. Методы, связанные с изменением свойств коррозионной среды. 4. Комбинированные методы. Электрические методы защиты основаны на изменении электрохимических свойств металла под действием поляризующего тока. Наибольшее распространение получила защита металлов при наложении на них катодной поляризации. Плотность тока, обеспечивающая полную катодную защиту, называется защитным током. Защита металла катодной поляризацией применяется для повышения стойкости металлических сооружений в условиях подземной (почвенной) и морской коррозии, а также при контакте металлов с агрессивными химическими средами. Она является экономически оправданной в тех случаях, когда коррозионная среда обладает достаточной электропроводностью и расход электроэнергии невелик. Катодная поляризация защищаемого металла достигается либо наложением тока от внешнего источника (катодная защита), либо созданием гальванической пары с менее благородным металлом (Al, Mg, Zn и их сплавы). Он играет здесь роль анода и растворяется (протекторная защита). Разработан метод защиты металлов от коррозии наложением анодной поляризации; он применим лишь к металлам и сплавам, способным пассивироваться при смещении их потенциала в положительную сторону. К электрическим методам защиты относится также электродренаж, применяемый для борьбы с разрушающим действием блуждающих токов на подземные сооружения. Защита металлов, основанная на изменении их свойств, осуществляется или легированием, или специальной обработкой их поверхности. Обработка поверхности металла с целью уменьшения коррозии проводится одним из следующих способов: покрытием металла пассивирующими пленками его труднорастворимых соединений (оксиды, фосфаты, сульфаты, вольфраматы), созданием защитных слоев из смазок, битумов, красок, эмалей, нанесением покрытий из других металлов, более стойких в данных конкретных условиях (лужение, цинкование, меднение, никелирование, хромирование, свинцование). Защитное действие большинства поверхностных пленок можно отнести за счет механической изоляции металла от окружающей среды. Общий недостаток этих методов – при удалении поверхностного слоя скорость коррозии на поврежденном месте резко возрастает. В этом отношении легирование является значительно более эффективным (хотя и более дорогим) методом повышения коррозионной стойкости металла. Изменение свойств коррозионной среды достигается или соответствующей обработкой среды, при которой уменьшается ее агрессивность (уменьшается концентрация компонентов, особенно опасных в коррозионном отношении, например, удаление кислорода деаэрацией или др. методами, подщелачивание, снижение общего содержания солей), или введением в коррозионную среду небольших добавок специальных веществ – замедлителей (ингибиторов) коррозии.
Ингибиторы коррозии разделяют в зависимости от условий их применения на жидкофазные и парофазные (летучие); жидкофазные ингибиторы делят, в свою очередь, на ингибиторы коррозии в нейтральных, щелочных и кислых средах. До настоящего времени еще не удалось найти эффективных ингибиторов коррозии металлов в щелочных растворах. В качестве ингибиторов кислотной коррозии применяются почти исключительно органические вещества, содержащие азот, серу или кислород. Действие ингибиторов кислотной коррозии связано с их адсорбцией на границе раздела металл-кислота. Действие большинства ингибиторов кислотной коррозии усиливается при одновременном введении добавок поверхностно-активных анионов (галогенидов, сульфидов, роданидов). Комбинированные методы сочетают в себе два или несколько способов защиты: битумные композиции + катодная защита (подземные трубопроводы); покраска + ингибитор коррозии как один из ингредиентов красителя (механическая защита + электрохимическая); катодная поляризация + ингибиторы (в нейтральных и кислых средах). Результативный эффект комбинированной защиты обычно выше суммарного эффекта соответствующих индивидуальных методов.
Список рекомендуемой литературы
1. Угай. Я.А. Общая и неорганическая химия [Текст]: учеб. для вузов - М.: Высшая школа. 2002. - 528 с. 2. Павлов. Н.Н. Общая и неорганическая химия [Текст]: учеб. для студентов вузов - М.: Дрофа. 2002. - 447 с. 3. Глинка. Н.Л. Общая химия [Текст]: учеб. пособие для нехим. спец. вузов - М.: Юрайт. 2010. - 886 с. 4. Химия [Текст]: учеб. для вузов по техн. напр. и спец. / Гуров. А.А.. Бадаев. Ф.З.. Овчаренко. Л.П.. Шаповал. В.Н. - М.: Московский гос. техн. ун-т им. Н.Э. Баумана. 2004. - 777 с. 5. Коровин. Н.В. Общая химия [Текст]: учеб. для вузов по техн. напр. и спец. - М.: Высшая школа. 2009. - 557 с. 6. Глинка, Н.Л. Задачи и упражнения по общей химии [Текст]: учеб. пособие для нехим. спец. вузов / под ред.: В.А. Рабиновича, Х.М. Рубиной - М.: Интеграл-Пресс, 2007. - 240 с. 7. Гольбрайх, З.Е. Сборник задач и упражнений по химии [Текст]: учеб. пособие для студентов / Гольбрайх, З.Е., Маслов, Е.И. - М.: АСТ: Астрель, 2004. - 383 с.
8. Луцик, В.И. Сборник контрольных заданий по основным разделам курса химии [Текст]; [Электронный ресурс]: учеб. пособие / Луцик, В.И., Соболев, А.Е.; Тверской гос. техн. ун-т - Тверь: ТГТУ, 2010. - 116 с. Сервер. 9. Коровин, Н.В. Лабораторные работы по химии [Текст]: учеб. пособие для студентов техн. напр. и спец. вузов / Коровин, Н.В., Мингулина, Э.И., Рыжова, Н.Г.; под ред. Н.В. Коровина - М.: Высшая школа, 2001. - 256 с. 10. Практикум по неорганической химии [Текст]: учеб. пособие для вузов / Алешин, В.А., Дунаева, К.М., Жиров, А.И., [и др.]; под ред. Ю.Д. Третьякова - М.: Академия, 2004. - 384 с. 11. Практикум по общей и неорганической химии [Текст]: учеб. пособие для вузов / Фролов, В.И., Курохтина, Т.М., Дымова, Н., [и др.]; под ред.: Н.Н. Павлова, В.И. Фролова - М.: Дрофа, 2002. - 302 с. - (66513-18) 12. Тестовые задания по общей и неорганической химии с решениями и ответами [Текст]: учеб. пособие / Лидин, Р.А., Савинкина, Е.В., Рукк, Н.С., Аликберова, Л.Ю. - М.: БИНОМ. Лаборатория знаний, 2004. - 230 с. 13. Лабораторные работы по химии: учеб.-метод. пособие по выполнению лаб. работ по курсу "Химия" для студ. нехим. спец. / сост. М.М. Усанова [и др.]; Тверской гос. техн. ун-т, Каф. БТиХ - Тверь: ТГТУ, 2002. - 68 с.
Оглавление
Теоретические аспекты электрохимических процессов
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-09; просмотров: 132; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.253.221 (0.02 с.) |
 ,
,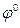 ‑ стандартный электродный потенциал, измеренный при стандартных условиях; R = 8.314 Дж/моль·К, универсальная газовая постоянная; Т – температура по шкале Кельвина; F – число Фарадея, равное 96500 Кл/моль; [Ox] и [Red] – произведения концентраций веществ, участвующих в процессе в окисленной (Ox) и восстановленной (Red) формах.
‑ стандартный электродный потенциал, измеренный при стандартных условиях; R = 8.314 Дж/моль·К, универсальная газовая постоянная; Т – температура по шкале Кельвина; F – число Фарадея, равное 96500 Кл/моль; [Ox] и [Red] – произведения концентраций веществ, участвующих в процессе в окисленной (Ox) и восстановленной (Red) формах. ,
, ‑ активность ионов металла в растворе электролита.
‑ активность ионов металла в растворе электролита.