
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Стадия адсорбции на твердом катализаторе. Физическая и химическая адсорбция. Вывод уравнения адсорбции Ленгмюра.
Адсорбцией называют процесс самопроизвольного увеличения концентрации вещества на границе раздела фаз. Адсорбирующееся вещество носит название адсорбата, адсорбирующее – адсорбента. Адсорбция является поверхностным процессом, который заключается во взаимодействии молекул или ионов адсорбата (газа или растворенного вещества) с поверхностью адсорбента за счет сил Ван-дер-Ваальса, водородных связей, электростатических сил. Стадия адсорбции каталитических процессов Адсорбция на катализаторе может протекать, в принципе, по двум основным механизмам: - физическая адсорбция, - Химическая адсорбция. Как правило, физическая адсорбция в любом случае предшествует химической адсорбции. Адсорбцию, обусловленную действием сил Ван-дер-Ваальса, называют физической адсорбцией. Физическая адсорбция – обратимый экзотермический процесс. Когда частица адсорбируется на поверхности, ее поступательное движение ограничивается, и поэтому процесс сопровождается уменьшением энтропии. При повышении температуры адсорбция уменьшается, а десорбция увеличивается. При физической адсорбции очень быстро устанавливается равновесие между адсорбированными частицами, находящимися в газовой фазе, т.е. равенство скоростей адсорбции и обратного ей процесса десорбции. Как правило, физическая адсорбция играет существенную роль тогда, когда температура газа понижается ниже критической, т.е. когда газ находится в виде пара. Крити́ческая температу́ра фазового перехода — такая температура, при которой плотность и давление насыщенного пара становится максимальными, а плотность жидкости, находящейся в динамическом равновесии с паром, становится минимальной. (т.е. пар и жидкость имеют практически одинаковые свойства). При критической температуре плотность жидкости и её насыщенного пара становятся равны, а поверхностное натяжение жидкости падает до нуля, потому исчезает граница раздела фаз жидкость-пар. При температуре, выше критической температуры, газ невозможно сконденсировать ни при каком давлении. Например, критическая температура кислорода - -118,5 °С, Химическая адсорбция – процесс адсорбции, который протекает в результате образования химической связи (обычно ковалентной). Энергия связи адсорбент – адсорбат достаточно велика и примерно равна энтальпии образования химических соединений (80...8000кДж/моль).
При низких температурах скорость хемосорбции так мала, что практически наблюдается только физическая адсорбция. Наоборот, при высоких температурах физическая адсорбция почти незаметна и происходит лишь хемосорбция. Скорость гетерогенно-каталитических реакций пропорциональна поверхностным концентрациям адсорбированных молекул. Так как на практике часто можно считать, что на поверхности катализатора имеет место адсорбированно-десорбционное равновесие, о поверхностных концентрациях реагентов можно судить по равновесному распределению молекул адсорбата между поверхностью твердого тела и газовой фазой. Это распределение зависит от давления, температуры, природы адсорбента и адсорбата, от площади адсорбента. Принято оценивать равновесное распределение по изотермам адсорбции, показывающим, каким образом количество адсорбированного вещества зависит от равновесного парциального давления данного газа при постоянной температуре. Существует несколько видов изотерм адсорбции. Рассмотрим вывод изотермы адсорбции Ленгмюра; в основе этого вывода лежит несколько допущений, учет которых приводит к более сложным уравнениям. 1) адсорбированные частицы связаны с определенными локализованными центрами на поверхности адсорбента; 2) каждый центр может присоединять только одну адсорбирующуюся частицу; 3) энергия адсорбированных частиц на всех центрах поверхности одинакова и не зависит от присутствия или отсутствия других адсорбирующихся частиц на соседних центрах. Уравнение изотермы адсорбции Ленгмюра может быть получено из условия равенства скоростей адсорбции и десорбции в момент равновесия (Wадс= Wдес).
Рассмотрим вывод уравнения изотермы адсорбции для случая, когда в газовой фазе присутствует только один компонент А, равновесное давление которого в газовой фазе равно рА. На поверхности имеется определенное число мест (или центров) адсорбции N0, часть которых NA занята адсорбированными молекулами, а часть N’=N0 - NA свободна. Скорость десорбции (испарения) принимается пропорциональной NA и равной Скорость десорбции (испарения) принимается пропорциональной NA и равной Wдес = k1NA, где k1 - константа скорости десорбции. Скорость адсорбции (конденсации) пропорциональна количеству свободных центров N’ и давлению газа: W адс = k2pAN’ = k2pA(N0 - NA), где k2 - константа скорости адсорбции. При равновесии W дес = W адс k1NA = k2pA(N0 - NA) Введем понятие «адсорбционный коэффициент» bА, равный отношению констант скоростей адсорбции и десорбции (т.е., по существу, константу адсорбционно-десорбционного равновесия):
Тогда получим
Отношение числа занятых центров к общему числу адсорбированных центров (степень заполнения поверхности) обозначим qА = NA/N0
Из уравнений следует, что при низких давлениях количество адсорбированного газа примерно пропорционально его давлению NA» N0bАpA Или qА» bАpA, (линейная зависимость между концентрацией адсорбированных частиц и рА) Наоборот, при сравнительно высоких давлениях, когда bApA» 1, адсорбат стремится заполнить все свободные места и
где bj - адсорбционный коэффициент реагента J; Nj - количество адсорбционных центров, заполненных молекулами вещества J; рj - парциальное давление вещества J; qj - степень заполнения поверхности адсорбированным веществом J. Адсорбционный коэффициент любого вещества А (bA) зависит от температуры и от теплоты адсорбции (энергии взаимодействия адсорбата с поверхностью), которая в рамках изотермы Ленгмюра принимается постоянной и независящей от заполнения: bA = bA,0 exp(QA/RT), где bA,0 – предэкспонента, или частотный множитель; QA- теплота адсорбции компонента А (при этом Q входит в уравнение со знаком «+», при адсорбции, как правило, теплота выделяется. Каталитическую реакции на твердом катализаторе можно разбить на основные типичные стадии: 1) диффузионный перенос реагента А к внешней поверхности катализатора (внешняя диффузия); 2) диффузионный перенос реагента А в поры катализатора к его внешней поверхности (внутренняя диффузия); 3) адсорбция реагента А на внешней и внутренней поверхностях катализатора; 4) Поверхностная реакция с образованием активированного комплекса адсорбции;
6) Десорбция продуктов реакции с внутренней и внешней поверхности адсорбента (катализатора) с высвобождением активных центров на поверхности катализатора; 7) Диффузия продуктов из пор к внешней поверхности катализатора (обратная внутренняя диффузия); 8) Диффузия продуктов от внешней поверхности катализатора в поток (обратная внешняя диффузия).
О скорости процесса Скорость (удельная скорость) химической реакции w rJ - количество (моль) n J одного из реагентов или продуктов, прореагировавших (или образовавшихся) в единицу времени t в единице реакционного пространства
Явления переноса
1. ρ и μ= const (T=const) 2. течение стационарное => 3. течение одномерное wz≠0;wx=wy=0 4. течение жидкости происходит на участке с установившимся течением Запишем ур-ние Навье-Стокса и урав-ние неразрывности 1.
2. Уравнение новье-стокса
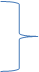
 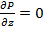
Модифицированное давление p- p gz=P
Пусть (2)=С1, т.е. мы разбиваем выражение (2) на два уравн-ия и => p=C1* z+C2. Зададим граничные условия Z=0; p=pвх; z=L; p=pвых=> ∆p- перепад давлений на участке длины L
Сложим, левые и правые части и подставим в (3)
Уравн-ия (3) в декартовых координатах заменим ур-ниями (8),(9),кот. Являются обыкновенным диф уравнением с частной производной 2-го порядка, для решения кот-го урав. (8)-(9) должны добавится след. Условия однозначности: граничные условия: r=R, wz(R)=0 (10) условие ограниченности wz при 0≤r≤R, wz≠∞ (11) после двухкратного интегрирования (8) получаем
(11)=> A=0; (10) и A=0 => B=∆pR2/4μl Подставляя А и В в (12), получаем решение задачи Пуазейля
Характеризует распределение скорости жидкости в плоскости по координатам x и y,кот.явля-ся параболическим
Характеризует распределение скорости жидкости в плоскости покоординатам x и y,которые являются параболическими.
Химическая технология(ОХТ)
|
|||||||||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 217; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.107.96 (0.029 с.) |
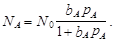 bА = k2/k1.
bА = k2/k1.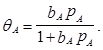 Тогда
Тогда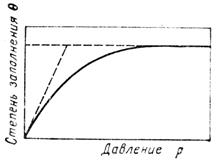
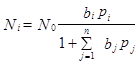 При адсорбции из смеси n газообразных веществ (A,B,R,S…) аналогичный вывод приводит к уравнению
При адсорбции из смеси n газообразных веществ (A,B,R,S…) аналогичный вывод приводит к уравнению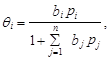 Или
Или 5) Перегруппировка адсорбированных комплексов с образованием адсорбированных комплексов из продукта реакции и адсорбента;
5) Перегруппировка адсорбированных комплексов с образованием адсорбированных комплексов из продукта реакции и адсорбента;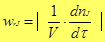 Скорость химических превращений
Скорость химических превращений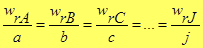 Из законов стехиометрии следует, что
Из законов стехиометрии следует, что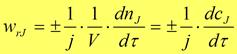
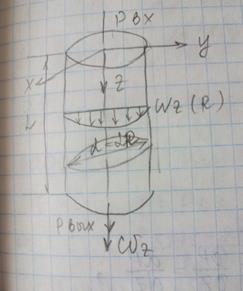 4.Течение в круглой трубе.
4.Течение в круглой трубе.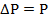 вх-Pвых,,жидкость ньютовская,несжимаемая;течение изотермическое=>допущения:
вх-Pвых,,жидкость ньютовская,несжимаемая;течение изотермическое=>допущения: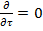
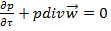
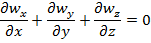
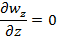
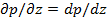
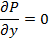
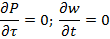
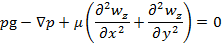
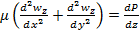 (2)
(2)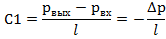
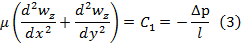
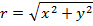
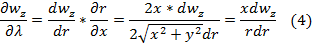
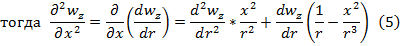
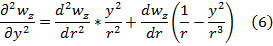
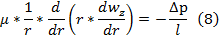 ,где
,где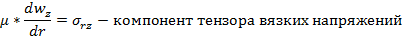
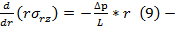 уравнение Коши для течения в цилиндрических трубах с постоянной площадью сечения.
уравнение Коши для течения в цилиндрических трубах с постоянной площадью сечения.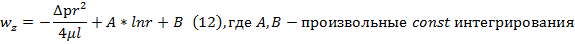
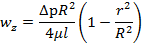
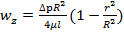 -уравнение Пуазейля
-уравнение Пуазейля


