
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Равновесие в процессах пар-ж для идеальных смесей. Закон Рауля. Диаграммы t-x-y и x-y.
АЗЕОТРОПНЫЕ СМЕСИ (азеотропы) (от греч. а--приставка, означающая отрицание или отсутствие к.-л. свойства, Азеотропные смеси встречаются как в двойных, так и в многокомпонентных системах. Нек-рые в-ва особенно склонны к образованию азеотропных смесей, особенно с представителями к.-л. одного го-мологич. ряда. В многокомпонентных системах можно наблюдать явления полиазеотропии, когда гомологи и их изомеры из разл. рядов могут образовывать между собой большое число двух- и многокомпонентных азеотропных смесей, охватывающих широкий концентрац. интервал. Законы Дальтона. 1. Давление смеси газов равно сумме их парц. давлений.
Из этого следует, что парц. давление компонента газовой смеси равно произведению давления смеси на молярную долю этого компонента. 2. Р-римость компонента газовой смеси в данной жидкости при постоянной т-ре пропорциональна парц. давлению этого компонента и не зависит от давления смеси и природы др. компонентов. Оба закона Дальтона строго выполняются для идеальных газов. Для реальных газов эти законы применимы при условии, если их растворимость невелика, а поведение близко к поведению идеального газа. ЗАКОН РАУЛЯ: относит. понижение парциального давления пара р-рителя над разб. бинарным р-ром неэлектролита равно молярной доле растворенного в-ва xв:
где рА-парциальное давление р-рителя,
Если пар над р-ром нельзя считать идеальным газом, давления
Р-ры, для к-рых Рауля закон выполняется во всем интервале концентраций для обоих компонентов, наз. идеальными (совершенными). Для идеального р-ра термодинамич. активность компонента aА равна его молярной доле хА (аА = = xА), а хим. потенциал компонента, по определению, равен:
где Т-абс. т-ра, R-газовая постоянная,
|
|||||
|
Последнее изменение этой страницы: 2017-02-17; просмотров: 182; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.28.48 (0.004 с.) |
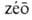 -киплю и
-киплю и  -поворот, изменение), жидкие смеси, характеризующиеся равенством составов равновесных жидкой и паровой фаз. При их перегонке образуется конденсат того же состава, что и исходный р-р; поэтому азеотропные смеси наз. также нераздельнокипящими. Наличие азеотропных смесей существенно затрудняет разделение жидких смесей и требует применения специальных методов ректификации.
-поворот, изменение), жидкие смеси, характеризующиеся равенством составов равновесных жидкой и паровой фаз. При их перегонке образуется конденсат того же состава, что и исходный р-р; поэтому азеотропные смеси наз. также нераздельнокипящими. Наличие азеотропных смесей существенно затрудняет разделение жидких смесей и требует применения специальных методов ректификации.


 -давление на-сыщ. пара чистого р-рителя. Соотв. для молярной доли р-рителя xA можно записать:
-давление на-сыщ. пара чистого р-рителя. Соотв. для молярной доли р-рителя xA можно записать:
 и рА заменяют на фугитивности fА и
и рА заменяют на фугитивности fА и  :
:

 -стандартный хим. потенциал (см. Стандартное состояние). Парциальное давление растворенного в-ва при постоянной т-ре пропорционально его молярной доле (см. Генри закон), зависимость осмотич. давления р-ра от концентрации растворенного в-ва выражается законом Вант-Гоффа (см. Оcмос).
-стандартный хим. потенциал (см. Стандартное состояние). Парциальное давление растворенного в-ва при постоянной т-ре пропорционально его молярной доле (см. Генри закон), зависимость осмотич. давления р-ра от концентрации растворенного в-ва выражается законом Вант-Гоффа (см. Оcмос).


