
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Моделирование химических процессов и аппаратов
На основе математических моделей химических процессов и аппаратов решаются следующие задачи: n выбор конструкции и размера аппарата; n определение оптимальных режимов его работы; n разработка систем автоматического управления.
Любой химико-технологический процесс, как правило, сопровождается перемещением некоторых материальных потоков жидкости, газа или твердых частиц. Структура потоков оказывает существенное влияние на эффективность химико-технологических процессов. При этом математическая модель структуры потока является основой для построения математической модели процесса в целом. Типовые математические модели структуры потоков в аппаратах 1.
Модель АИС соответствует аппарату, в котором поступающее в него вещество мгновенно равномерно распределяется по всему его объему. При этом концентрации и температура на выходе из реактора те же, что в объеме, а на входе претерпевают скачок. Время пребывания в АИС распределено не равномерно. Уравнение, описывающее изменение концентрации в зоне идеального смешения имеет вид:
где V – объем реактора, м3; Q – объемный расход, м3/с; С – концентрация, моль/м3; τ – время, c. Аналогично, заменяя концентрацию температурой, получаем уравнение теплового баланса:
, где Ср – изобарная теплоемкость, Дж/м3∙К;
Х – объемная доля; r – плотность, кг/м3; T – температура, К. Индексы: R – внутренние конструкции реактора; P – реакционная смесь; K – катализатор. Поскольку в аппаратах химической технологии концентрация вещества может изменяться не только в результате его движения, но и вследствие химических реакций, уравнение материального баланса АИС будет иметь вид:
где w – скорость химического превращения вещества, моль/м3∙с. Уравнение теплового баланса запишется как:
где qr – удельный тепловой эффект реакции, Дж/моль; КТ – коэффициент теплопередачи, Вт/(м2×К); F – поверхность теплообмена, м2. В правой части уравнения теплового баланса записаны:
В левой части уравнения В уравнениях материального и теплового балансов скорость химического превращения в общем виде определяется как функция состава и температуры реакционной смеси:
где Начальные условия (НУ). НУ определяют поля температур и концентраций в начальный момент времени: τ0=0, C0=C(0), T0=T(0). Ограничения. Ограничения определяют диапазон, в которых работает реактор. Рабочий диапазон температур:
Рабочий диапазон входных концентраций:
Рабочий диапазон объемного расхода:
Для стационарного режима изменения количества вещества и тепла во времени равны нулю, т.е.
Полагая, что для АИС в стационарных условиях QВХ = QВЫХ = Q, уравнение материального баланса запишется:
уравнение теплового баланса:
Обычно материальный баланс представляет собой систему уравнений, количество которых равно количеству ключевых компонентов:
Кроме того, если ключевое вещество участвует в нескольких реакциях, то скорость его превращения будет равна сумме скоростей реакций, в которых участвует данное вещество. Уравнение теплового баланса в этом случае имеет вид:
Уравнение кинетики в общем виде записывается как:
2.
Условия физической реализуемости этой модели выполняются в случае поршневого потока, когда предполагается, что в направлении его движения смешивание полностью отсутствует, а в направлении, перпендикулярном движению, происходит идеальное смешение. Время пребывания всех частиц в системе одинаково и равно отношению объема системы к объемному расходу жидкости, τ=V/Q. Уравнение, описывающее изменение концентрации в зоне идеального вытеснения, имеет вид:
где S – площадь поперечного сечения, м2; Z – координата длины, м; U – скорость потока, м/с. Здесь левая часть – изменение количества вещества в выделенном элементарном слое. Первое слагаемое правой части – количество вещества, вносимого с потоком в выделенный объем, второе слагаемое – количество вещества, уносимого с потоком. Раскрыв скобки и сократив на dz, получим:
где Q=U×S – объемный расход, м3/с. Уравнение теплового баланса:
Для АИВ, в котором протекает химическая реакция и имеется теплообменник, уравнения материального и теплового балансов имеют вид:
где FУД = F/V – удельная поверхность теплообмена, м2/м3. Уравнение кинетики в общем виде записывается:
где В математическую модель АИВ входят также граничные и начальные условия и ограничения. Граничные условия для АИВ - условия протекания процесса на входе в слой: z=0, C(0,τ)=CВХ, T(0,τ)=TВХ Начальные условия устанавливают значения концентраций и температуры в реакторе в начальный момент времени: τ = 0, C(z,0) = C(0), T(z,0) = T(0) Ограничения:
В случае стационарного режима: - уравнение материального баланса:
- уравнение теплового баланса:
Поскольку τ = V/Q = S·L/Q откуда L =τ· Q/S и dz = (Q/S) · d τ, делая подстановку, получаем:
Поскольку переменная τ имеет размерность времени и обозначает время пребывания элементарного объема реагирующей смеси в зоне реакции, то уравнения (*) и (**) можно рассматривать так же как математическое описание АИС периодического действия.
ПОЛОЖЕНИЯ И ОПРЕДЕЛЕНИЯ КИНЕТИКИ ХИМИЧЕСКИХ РЕАКЦИЙ
|
||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 492; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.145.114 (0.01 с.) |
 Модель аппарата идеального смешения
Модель аппарата идеального смешения ,
, ,
, – усредненная теплоемкость аппарата;
– усредненная теплоемкость аппарата;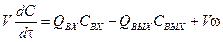 ,
, ,
, – ввод тепла с входящим потоком;
– ввод тепла с входящим потоком; – вывод тепла с уходящим потоком;
– вывод тепла с уходящим потоком; – выделение тепла за счет реакции;
– выделение тепла за счет реакции; – отвод тепла через поверхность теплообмена.
– отвод тепла через поверхность теплообмена. – накопление тепла.
– накопление тепла.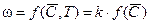 ,
, - вектор концентраций; k - константа скорости.
- вектор концентраций; k - константа скорости.


 и
и 
 ,
, .
.

 , k =1, 2,… p
, k =1, 2,… p Модель аппарата идеального вытеснения.
Модель аппарата идеального вытеснения.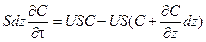 ,
, ,
, или после упрощения:
или после упрощения: 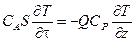
 ,
, ,
,
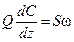

 (*)
(*) (**)
(**)


