
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Застосування 1-го закону термодинаміки. Теплові ефекти ізобарних та ізохорних процесівСтр 1 из 8Следующая ⇒
Фізична хімія Методичні вказівки до модульних контрольних робот
Київ НТУУ «КПІ» ЗМІСТ
ВСТУП
Історія розвитку металургійної та ливарної технології переконливо довела, що фізична хімія має не тільки теоретичне, а й велике практичне значення. Фізична хімія є введенням в теорію металургійних процесів, теоретичні основи ливарного виробництва і металографію. Вона відкриває широкі можливості активного керування фізико-хімічними процесами, раціонального використання сировини, підвищення якості продукції, економії енергетичних ресурсів, захисту навколишнього середовища і багато інше. В опануванні цією важливою навчальною дисципліною суттєву роль відіграють практичні заняття. Саме вони дозволяють сформувати фізико-хімічне мислення, навчити доводити рішення до кінцевого числового результату, виховати відповідальність за результати розрахунків, навчити творчо виконувати теоретичні знання для вирішення виробничих задач. Основна мета методичних вказівок – підготувати студентів металургійного спрямування (металургів, ливарників) до фізико-хімічних розрахунків і на конкретних виробничих прикладах розкрити можливості застосування теорії на практиці. Методичні вказівки охоплюють основні теми курсу фізичної хімії, що передбачені навчальною програмою: хімічна термодинаміка та хімічні рівноваги, фазові рівноваги, поверхневі явища та адсорбція, хімічна кінетика. На початку кожного розділу наведені стислі теоретичні відомості і основні формули, що використовуються при вирішенні задач за темою. Далі наводяться приклади використання цих законів і формул з необхідними методичними вказівками при рішенні типових задач, опрацювання яких полегшує роботу студентів при роботі на аудиторних практичних занять.
ХІМІЧНА ТЕРМОДИНАМІКА Теплоємність Теплоємність – це кількість теплоти, що необхідна для нагрівання системи на один градус. Істинна теплоємність – відношення безмежно малої кількості теплоти, яка підведена до системи, до відповідно безмежно малої зміни температури.
Середня теплоємність – відношення кількості підведеної теплоти в систему до викликаної цим зміни температури.
Оскільки dQp = ΔH dQv = ΔU, то істинна та середня теплоємності при Р= const: V= const: Взаємозв’язок середньої та істинної теплоємностей описується:
Теплоємність речовини – це кількість теплоти, яка необхідна для нагрівання певної кількості речовини на 1К. Молярна теплоємність Взаємозв’язок молярної та питомої теплоємностей визначається рівнянням:
Температурі Залежність теплового ефекту хімічного процесу від температури ілюструє закон Кірхгофа.
де Температурний коефіцієнт теплового ефекту процесу дорівнює зміні теплоємності системи в наслідок цього процесу. Аналіз рівняння Кірхгофа Якщо тепловий ефект ендотермічного процесу ( тепловий ефект екзотермічного процесу ( Зменшення температури чинить протилежну дію. Якщо тепловий ефект ендотермічного процесу ( тепловий ефект екзотермічного процесу ( Зменшення температури чинить протилежну дію. Якщо тепловий ефект реакції не залежить від температури. Якщо відомий тепловий ефект реакції за с.у. ΔН0298, то за законом Кірхгофа можна розрахувати його для іншої температури:
При наближених розрахунках: 1) за умови, що
2) В невеликому інтервалі температур можна припустити, що
3) При точних розрахунках потрібно враховувати температурну залежність
Приклад 10. Розрахувати тепловий ефект хімічного процесу MnO2(кр.) + C(графит) → 2CO(г.) + Mn(α) за умов, що ΔСр = const при температурі 500 К. Розв’язок. З попередніх прикладів виписуємо, що
Звідси випливає, що тепловий ефект даного хімічного процесу збільшується з підвищенням температури. Абсолютна ентропія Абсолютна ентропія – це ентропія речовини при заданій температурі, яка розрахована від її нульового значення при абсолютному нулі температур. Абсолютна ентропія є сумою змін ентропії при нагріванні речовини від 0 К до заданої температури, а саме: змін ентропії при нагріванні твердої речовини від температури абсолютного нуля до температури плавлення, при переході з твердого в рідкий стан, при нагріванні рідини від температури плавлення до температури кипіння, внаслідок випаровування при температурі кипіння та при нагріванні пари від температури кипіння до заданої Т.
Ентропія індивідуальної кристалічної речовини у вигляді ідеально твердого тіла (тверда речовина з ідеальними кристалічними ґратками, де всі ґрати зайняті атомами чи молекулами) при абсолютному нулі дорівнює нулю.
Згідно з постулатом Планка абсолютна ентропія одного моля газоподібної речовини при температурі Т буде дорівнювати сумі зміни ентропії при переході речовини з одного агрегатного стану в інший при нагріванні твердої, рідкої та газоподібної речовини від абсолютного нуля до температури Т. Тоді можливі такі процеси:
тоді
де Приклад 13. Визначити зміну ентропії в результаті нагрівання 1 моля PbO(черв.) при Р = 1 атм від 298 К до 2000 К (
Розв’язок. Користуючись рівнянням (1.33) сумарна зміна ентропії буде становити:
У відповідності з рівнянням (1.32) абсолютне значення ентропії буде виражатися як Цей процес схематично можна представити наступним чином: 1) згідно з рівнянням (1.26) нагрівання
згідно з рівнянням (1.28) поліморфне перетворення
2) нагрівання
3) фазове перетворення
4) нагрівання
5) фазове перетворення
6) нагрівання пари до 2000 К у відповідності з рівнянням (1.26)
Ентропія при нагріванні від 298 К зростає майже в 3,3 рази. Збільшення ентропії за рахунок нагрівання становить ХІМІЧНІ РІВНОВАГИ Рівняння ізобари та ізохори P = const
Аналіз рівнянь ізобари та ізохори хімічної реакції: 1. Якщо 2. Якщо 3. Якщо
ФАЗОВІ РІВНОВАГИ Двокомпонентні системи ХІМІЧНА КІНЕТИКА ПОВЕРХНЕВІ ЯВИЩА. АДСОРБЦІЯ Поверхнева енергія рідини на межі з даним середовищем кількісно характеризується питомою поверхневою енергією або поверхневим натягом
де А – робота, що витрачається на утворення 1 м2 нової поверхні, або сила (Н/м), що діє на одиницю довжини поверхні ( Зважаючи на те, що Поверхневий натяг рідини знаходиться в оберненій залежності від температури і тиску пари над нею. З підвищенням температури поверхневий натяг зменшується, тому що середня відстань між молекулами збільшується. В результаті цього послаблюються сили, що діють між молекулами, а це приводить до зниження поверхневого натягу. Залежність поверхневого натягу від абсолютної температури має вигляд:
де З підвищенням температури поверхневий натяг більшості металів також лінійно знижується у відповідності з рівнянням:
Поверхневий натяг розчинів пов'язаний з його концентрацією рівнянням Шишковського:
де Розчинені речовини змінюють поверхневий натяг. Речовини, що значно знижують поверхневий натяг називаються поверхнево-активними. Зміна поверхневого натягу розчину є наслідком процесу адсорбції. Адсорбція Зв'язок між адсорбцією
де Для наближених розрахунків тоді
При адсорбції на межі поділу тверде тіло – рідина через неможливість дослідного визначення поверхневого натягу кількість адсорбованої речовини розраховують за зміною концентрації розчину. Залежність кількості речовини, адсорбованої 1 г адсорбенту, від рівноважної концентрації при постійній температурі виражається емпіричним рівнянням Фрейндліха:
де Стала
Визначивши
Рисунок 5.1 – Ізотерма адсорбції в логарифмічних координатах Якщо на поверхні твердого тіла при постійній температурі адсорбується газ, то залежність між величиною адсорбції
де Рівняння (5.8) називається рівнянням ізотерми адсорбції. Якщо твердим тілом адсорбується речовина, що знаходиться в розчині, то залежність між адсорбцією і концентрацією адсорбованої речовини виражається рівнянням:
де Величина Рівняння (5.8) або (5.9) можуть бути перетворені наступним чином:
З рівняння видно, що Приклад 40. Відомі константи рівняння Шишковського для водного розчину валеріанової кислоти при 273 К: Розв’язок. Користуючись рівнянням(5.2) запишемо: (75,49 – 52,1) . 10-3 = 2,303 . 14,72 . 10-3. lg (1 + 10,4С);
Приклад 41. Знайти поверхневу активність масляної кислоти на межі водного розчину з повітрям при 283 К і концентрації
Визначити адсорбцію масляної кислоти на поверхні розчин – повітря. Розв’язок. Поверхневу активність
Рисунок 5.2 – Залежність поверхневого натягу від концентрації Адсорбцію знаходимо за рівнянням Гіббса:
Рекомендована література 1. Жуховицкий А. А. Физическая химия: учеб. [для вузов] /А. А. Жуховицкий, Л.А. Шварцман. – М.: Металлургия, 1987. - 688 с. 2. Лебідь В.І. Фізична хімія [підручник для вищих учбових закладів] /В.І. Лебідь – Харків «Фаліо», 2005. – 478 с. 3. Стромберг А.Г. Физическая химия: учеб. [для вузов] /А.Г. Стромберг, Д.П. Семченко. – М.: Высшая школа, 1988. – 496 с. 4. Мчедлов – Петросян М.О. Основи колоїдної хімії: фізико – хімія поверхневих явищ і дисперсних систем: підручник / М.О. Мчедлов – Петросян, В.І. Лебідь, О. М. Глазкова та ін. – Х.: ХНУ ім.. В.Н. Карабіна, 2004. – 300 с. 5. Воюцкий С.С. Курс коллоидной химии / С.С. Воюцкий. – М.: Химия, 1975. – 512 с. 6. Кабачный В.И. Руководство к лабораторным работам по физической и коллоидной химии [учебное издание] / Кабачный В.И., Колесник В.П., Грицан Л.Д. и др. – Х.: НФАУ, 2001. – 192 с. 7. Фізична хімія (Частина I): Методичні вказівки до виконання лабораторних робіт для студентів інженерно-фізичного факультету. - Київ: Вид-тво КПІ, 2009. - 38 с. 8. Фізична хімія (Частина II): Методичні вказівки до виконання лабораторних робіт для студентів інженерно-фізичного факультету. - Київ: Вид-тво КПІ, 2009. - 47 с. 9. Методические указания по курсу физической химии для студентов инженерно-физического факультета дневной и вечерней форм обучения. - Киев: Изд-во КПИ, 1986. - 54 с. 10. Равдель А.А. Краткий справочник физико-химических величин / А. А. Равдель, А.М. Пономарева. – Л.: Химия, 1983, 1991 – 232 с. Фізична хімія Методичні вказівки до модульних контрольних робот
Київ НТУУ «КПІ» ЗМІСТ
ВСТУП Історія розвитку металургійної та ливарної технології переконливо довела, що фізична хімія має не тільки теоретичне, а й велике практичне значення. Фізична хімія є введенням в теорію металургійних процесів, теоретичні основи ливарного виробництва і металографію. Вона відкриває широкі можливості активного керування фізико-хімічними процесами, раціонального використання сировини, підвищення якості продукції, економії енергетичних ресурсів, захисту навколишнього середовища і багато інше. В опануванні цією важливою навчальною дисципліною суттєву роль відіграють практичні заняття. Саме вони дозволяють сформувати фізико-хімічне мислення, навчити доводити рішення до кінцевого числового результату, виховати відповідальність за результати розрахунків, навчити творчо виконувати теоретичні знання для вирішення виробничих задач. Основна мета методичних вказівок – підготувати студентів металургійного спрямування (металургів, ливарників) до фізико-хімічних розрахунків і на конкретних виробничих прикладах розкрити можливості застосування теорії на практиці. Методичні вказівки охоплюють основні теми курсу фізичної хімії, що передбачені навчальною програмою: хімічна термодинаміка та хімічні рівноваги, фазові рівноваги, поверхневі явища та адсорбція, хімічна кінетика. На початку кожного розділу наведені стислі теоретичні відомості і основні формули, що використовуються при вирішенні задач за темою. Далі наводяться приклади використання цих законів і формул з необхідними методичними вказівками при рішенні типових задач, опрацювання яких полегшує роботу студентів при роботі на аудиторних практичних занять. ХІМІЧНА ТЕРМОДИНАМІКА Застосування 1-го закону термодинаміки. Теплові ефекти ізобарних та ізохорних процесів Тепловий ефект хімічної реакції –це теплота, яка виділяється чи поглинається в результаті перебігу до кінця хімічної реакції при P = const дорівнює зміні ентальпії системи (ΔН), а за умов V = const – зміні внутрішньої енергії системи (ΔU), при цьому мається на увазі, що продукти реакції мають таку ж саму температуру як і вихідні речовини. Одиниці виміру Оскільки в термодинаміці прийнято вважати теплоту, яку поглинула система додатною, то: ΔН > 0 ендотермічна реакція (теплота поглинається); ΔН < 0 екзотермічна реакція (теплота виділяється).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 595; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.117.182.179 (0.118 с.) |
 хімічного процесу при будь – якій заданій
температурі
хімічного процесу при будь – якій заданій
температурі
 та
та 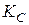
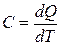
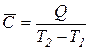
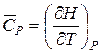
 ;
;
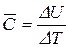 .
.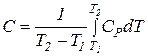
 має розмірність
має розмірність  , а питома
, а питома 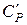 –
– 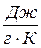 ,
, 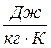 .
.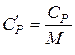 .
.
 ,
,
 – температурний коефіцієнт теплового ефекту.
– температурний коефіцієнт теплового ефекту. > 0, то зі зростанням температури:
> 0, то зі зростанням температури: > 0) – збільшується;
> 0) – збільшується; .
.
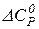 = 0, тоді
= 0, тоді  або
або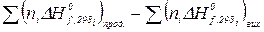 ;
;
 ;
;
 .
.
 , а
, а  . Користуючись рівнянням (1.21), запишемо:
. Користуючись рівнянням (1.21), запишемо:

 Зміна ентропії в цьому процесі буде така:
Зміна ентропії в цьому процесі буде така: , оскільки
, оскільки 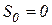 ,
,

 – теплоти поліморфного перетворення, плавлення та випаровування речовини;
– теплоти поліморфного перетворення, плавлення та випаровування речовини;  – температури поліморфного перетворення, плавлення та кипіння;
– температури поліморфного перетворення, плавлення та кипіння;  – відповідно молярні теплоємкості модифікації
– відповідно молярні теплоємкості модифікації  та
та  твердого, рідкого та газоподібного стану речовини.
твердого, рідкого та газоподібного стану речовини. ) та абсолютне значення при 2000 К
) та абсолютне значення при 2000 К  , якщо:
, якщо: ;
; 
 ;
; 
 ;
;  ;
;  ;
; 
 ;
;  ;
;  .
.
 .
. до
до 


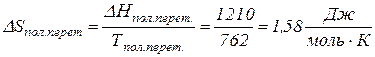 ;
; до
до 


 ;
; до
до 
 ;
;
 ;
;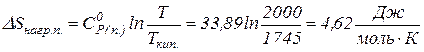

 .
. , за рахунок поліморфного перетворення
, за рахунок поліморфного перетворення 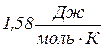 , плавлення
, плавлення  , випаровування
, випаровування  . Тобто
. Тобто  <
< 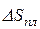 <
<  .
. – рівняння ізобари хімічної реакції в диференційній формі, де
– рівняння ізобари хімічної реакції в диференційній формі, де 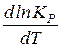 – температурний коефіцієнт логарифма константи рівноваги.
– температурний коефіцієнт логарифма константи рівноваги. > 0, то
> 0, то  :
: ,
,
 ) і прагне гранично скоротити поверхню рідини.
) і прагне гранично скоротити поверхню рідини. , то поверхневий натяг – це питомий ізобарно-ізотермічний потенціал:
, то поверхневий натяг – це питомий ізобарно-ізотермічний потенціал:  , де
, де  ,
,
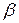 – коефіцієнт пропорціональності;
– коефіцієнт пропорціональності;  – виправлення (60);
– виправлення (60);  і
і  – критична температура і температура досліду відповідно;
– критична температура і температура досліду відповідно;  – поверхневий натяг при початковій температурі;
– поверхневий натяг при початковій температурі;  – поверхневий натяг при температурі досліду.
– поверхневий натяг при температурі досліду. .
.
 ,
,
 – концентрація розчину;
– концентрація розчину;  і
і  – константи.
– константи. на межі розчин – газ кількісно характеризується надлишком речовини (кмоль/м2) в поверхневому шарі у порівнянні з її концентрацією в об’ємі розчину. Як правило, речовини, що мають менший поверхневий у порівнянні з розчинником, знижують поверхневий натяг на границі фаз, а ті, що мають більший – підвищують.
на межі розчин – газ кількісно характеризується надлишком речовини (кмоль/м2) в поверхневому шарі у порівнянні з її концентрацією в об’ємі розчину. Як правило, речовини, що мають менший поверхневий у порівнянні з розчинником, знижують поверхневий натяг на границі фаз, а ті, що мають більший – підвищують. ,
,
 – концентрація розчину, кмоль/м3;
– концентрація розчину, кмоль/м3; 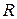 – універсальна газова стала, Дж/(кмоль.К);
– універсальна газова стала, Дж/(кмоль.К);  – зміна поверхневого натягу з концентрацією при незмінній поверхні, м2.Н/кмоль.
– зміна поверхневого натягу з концентрацією при незмінній поверхні, м2.Н/кмоль. ,
, .
.
 ,
,
 – кількість адсорбованої речовини, г;
– кількість адсорбованої речовини, г;  – кількість адсорбенту, г;
– кількість адсорбенту, г;  і
і  – сталі, що визначаються дослідним шляхом.
– сталі, що визначаються дослідним шляхом. для багатьох адсорбентів і адсорбованих речовин коливається в межах від 0,1 до 0,5. Сталі
для багатьох адсорбентів і адсорбованих речовин коливається в межах від 0,1 до 0,5. Сталі 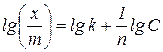 .
. (тобто
(тобто  = ОА;
= ОА;  .
.
 ,
,
 – тиск газу в стані рівноваги;
– тиск газу в стані рівноваги;  і
і  ,
,
 .
.
 є лінійною функцією тиску. Цим можна скористатись для графічного визначення сталих
є лінійною функцією тиску. Цим можна скористатись для графічного визначення сталих  ;
;  ; С = 0,375 кмоль/м3.
; С = 0,375 кмоль/м3.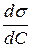 можна визначити графічним методом. Побудуємо графік залежності
можна визначити графічним методом. Побудуємо графік залежності  .
.
 .
. .
.


