
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Швидкість гомогенної хімічної реакції. Закон діючих мас. Порядок реакції ⇐ ПредыдущаяСтр 8 из 8
При незмінному об’ємі під швидкістю хімічної реакції розуміють зміну концентрації будь-якого з її учасників в одиницю часу:
Відповідно до закону діючих мас швидкість елементарної хімічної реакції аА + вВ → еЕ + fF в будь який момент часу виражається рівнянням
К1, К2 – константи швидкості реакції, які чисельно дорівнюють швидкості при одиничних концентраціях (чи парціальних тисках); СА, СВ – концентрації реагуючих речовин; РА, РВ – парціальні тиски речовин. Математична залежність швидкості хімічної реакції від концентрації (парціальних тисків) реагуючих речовин зветься кінетичним рівнянням і має вигляд степеневого рівняння, в якому показники степеня при добутках, які виражають концентрацію, називають порядком реакції по даній речовині. Сума показників степеня в кінетичному рівнянні являє собою загальний порядок реакції. Якщо реакція елементарна, проста, одностадійна, і механізм її перебігу розкривається хімічним рівнянням реакції, то порядок реакції по речовинам дорівнює відповідним стехіометричним коефіцієнтам рівняння реакції, тобто
Якщо реакція складна, багатостадійна, то показники степеня при концентрації реагентів відрізняються від стехіометричних коефіцієнтів, тоді
Швидкість таких реакцій визначає сама повільна стадія. За порядком хімічні реакції поділяються на реакції першого, другого, третього, нульового та дробового порядку. Порядок складних хімічних реакцій можна визначити тільки експериментально. Найчастіше зустрічаються реакції другого порядку, першого, більш рідко третього. Константа швидкості хімічної реакції є індивідуальною характеристикою швидкості даної реакції, не залежить від концентрації, визначається природою реагуючих речовин і при даній температурі є величина стала. На основі закону діючих мас для реакцій різних порядків можуть бути виведені рівняння для обчислювання константи швидкості реакції.
де τ – час, с0 – початкова концентрація, с – концентрація в даний момент часу τ. Одиниці виміру константи швидкості визначаються кінетичним рівнянням даної реакції. Одиниці виміру константи швидкості реакції першого порядку має розмірність [ τ-1 ], другого – [ τ-1·с-1 ], третього – [ τ-1·с-2 ].
Приклад 36. В реакції першого порядку 20% вихідної речовини прореагувало за 4 години. Скільки відсотків речовини прореагує за 7 годин. Розв’язок. З умов задачі випливає, що с0 = 1, с = 0,8 (оскільки реакція пройшла на 20%), згідно з рівнянням (4.5) запишемо:
4.2 Вплив температури на швидкість хімічної реакції З підвищенням температури швидкість хімічної реакції збільшується. Для приблизної оцінки впливу температури на швидкість хімічної реакції використовується емпіричне правило Вант-Гоффа: підвищення температури на кожні 10 К збільшує швидкість більшості реакцій в 2-4 рази.
γ – температурний коефіцієнт швидкості хімічної реакції; n – будь яке ціле чи дробове число. Температурний коефіцієнт можна визначити, якщо відомі константи швидкості для двох будь яких температур:
Використовуючи це рівняння, якщо відомий температурний коефіцієнт та константа швидкості при одній температурі, можна визначити константу швидкості хімічної реакції при іншій температурі. Температурний коефіцієнт має постійне значення для невеликих інтервалів температур. З підвищенням температури γ зменшується. В більш широкому інтервалі температур залежність константи швидкості хімічної реакції від температури може бути проілюстровано рівнянням Арреніуса:
де ЕА – енергія активації реакції, яка дорівнює надлишковій енергії, яка необхідна для здійснення елементарного акту реакції. Вона мало залежить від температури і є величиною сталою для даної реакції. За величиною енергії активації можна робити висновки щодо швидкості перебігу процесу. Чим менше значення енергії активації, тим більша швидкість процесу. Для більшості реакцій величина енергії активації знаходиться у межах 80 - 240 Приклад 37. Розрахувати енергію активації та константу швидкості при 800 К, якщо константа швидкості цієї реакції при 629 та 716 К відповідно складають 2,5·10 -3 та 0,14
Розв’язок. Згідно рівнянню (4.8) запишемо: З рівняння (4.8). випливає, що
Приклад 38. Визначити в скільки разів збільшиться швидкість хімічної реакції при підвищенні температури від 20 до 50 0С, якщо температурний коефіцієнт складає 2,2. Розв’язок. Згідно рівнянню (4.7) запишемо: Приклад 39. При якій температурі, яка відрізняється від стандартної, необхідно проводити реакцію, щоб її швидкість збільшилась в 40 разів? Температурний коефіцієнт складає 3,2. Розв’язок. Якщо рівняння (4.7) прологарифмувати, отримаємо:
ПОВЕРХНЕВІ ЯВИЩА. АДСОРБЦІЯ Поверхнева енергія рідини на межі з даним середовищем кількісно характеризується питомою поверхневою енергією або поверхневим натягом
де А – робота, що витрачається на утворення 1 м2 нової поверхні, або сила (Н/м), що діє на одиницю довжини поверхні ( Зважаючи на те, що Поверхневий натяг рідини знаходиться в оберненій залежності від температури і тиску пари над нею. З підвищенням температури поверхневий натяг зменшується, тому що середня відстань між молекулами збільшується. В результаті цього послаблюються сили, що діють між молекулами, а це приводить до зниження поверхневого натягу. Залежність поверхневого натягу від абсолютної температури має вигляд:
де З підвищенням температури поверхневий натяг більшості металів також лінійно знижується у відповідності з рівнянням:
Поверхневий натяг розчинів пов'язаний з його концентрацією рівнянням Шишковського:
де Розчинені речовини змінюють поверхневий натяг. Речовини, що значно знижують поверхневий натяг називаються поверхнево-активними. Зміна поверхневого натягу розчину є наслідком процесу адсорбції. Адсорбція Зв'язок між адсорбцією
де Для наближених розрахунків тоді
При адсорбції на межі поділу тверде тіло – рідина через неможливість дослідного визначення поверхневого натягу кількість адсорбованої речовини розраховують за зміною концентрації розчину. Залежність кількості речовини, адсорбованої 1 г адсорбенту, від рівноважної концентрації при постійній температурі виражається емпіричним рівнянням Фрейндліха:
де Стала Визначивши
Рисунок 5.1 – Ізотерма адсорбції в логарифмічних координатах Якщо на поверхні твердого тіла при постійній температурі адсорбується газ, то залежність між величиною адсорбції
де Рівняння (5.8) називається рівнянням ізотерми адсорбції. Якщо твердим тілом адсорбується речовина, що знаходиться в розчині, то залежність між адсорбцією і концентрацією адсорбованої речовини виражається рівнянням:
де Величина Рівняння (5.8) або (5.9) можуть бути перетворені наступним чином:
З рівняння видно, що Приклад 40. Відомі константи рівняння Шишковського для водного розчину валеріанової кислоти при 273 К: Розв’язок. Користуючись рівнянням(5.2) запишемо: (75,49 – 52,1) . 10-3 = 2,303 . 14,72 . 10-3. lg (1 + 10,4С);
Приклад 41. Знайти поверхневу активність масляної кислоти на межі водного розчину з повітрям при 283 К і концентрації
Визначити адсорбцію масляної кислоти на поверхні розчин – повітря. Розв’язок. Поверхневу активність
Рисунок 5.2 – Залежність поверхневого натягу від концентрації Адсорбцію знаходимо за рівнянням Гіббса:
Рекомендована література 1. Жуховицкий А. А. Физическая химия: учеб. [для вузов] /А. А. Жуховицкий, Л.А. Шварцман. – М.: Металлургия, 1987. - 688 с. 2. Лебідь В.І. Фізична хімія [підручник для вищих учбових закладів] /В.І. Лебідь – Харків «Фаліо», 2005. – 478 с. 3. Стромберг А.Г. Физическая химия: учеб. [для вузов] /А.Г. Стромберг, Д.П. Семченко. – М.: Высшая школа, 1988. – 496 с. 4. Мчедлов – Петросян М.О. Основи колоїдної хімії: фізико – хімія поверхневих явищ і дисперсних систем: підручник / М.О. Мчедлов – Петросян, В.І. Лебідь, О. М. Глазкова та ін. – Х.: ХНУ ім.. В.Н. Карабіна, 2004. – 300 с. 5. Воюцкий С.С. Курс коллоидной химии / С.С. Воюцкий. – М.: Химия, 1975. – 512 с. 6. Кабачный В.И. Руководство к лабораторным работам по физической и коллоидной химии [учебное издание] / Кабачный В.И., Колесник В.П., Грицан Л.Д. и др. – Х.: НФАУ, 2001. – 192 с. 7. Фізична хімія (Частина I): Методичні вказівки до виконання лабораторних робіт для студентів інженерно-фізичного факультету. - Київ: Вид-тво КПІ, 2009. - 38 с. 8. Фізична хімія (Частина II): Методичні вказівки до виконання лабораторних робіт для студентів інженерно-фізичного факультету. - Київ: Вид-тво КПІ, 2009. - 47 с. 9. Методические указания по курсу физической химии для студентов инженерно-физического факультета дневной и вечерней форм обучения. - Киев: Изд-во КПИ, 1986. - 54 с. 10. Равдель А.А. Краткий справочник физико-химических величин / А. А. Равдель, А.М. Пономарева. – Л.: Химия, 1983, 1991 – 232 с.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 430; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.168.172 (0.052 с.) |
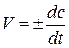 ,
,
 чи
чи  ,
,
 ,
,

 .
.
 .
Для другого порядку
.
Для другого порядку  .
Для третього порядку
.
Для третього порядку  .
.
 год-1. Звідси
год-1. Звідси  . Оскільки початкова концентрація с0 = 1, то с = 1- 0,67 = 0,33. За 7 годин реакція пройде на 33%.
. Оскільки початкова концентрація с0 = 1, то с = 1- 0,67 = 0,33. За 7 годин реакція пройде на 33%. чи
чи 

 чи
чи  ,
,
 .
. .
. ;
;  .
. , приймаємо, що Т1 = 716 К, Т2 = 800 К, тоді
, приймаємо, що Т1 = 716 К, Т2 = 800 К, тоді ,
,
 .
. рази.
рази. , тоді
, тоді 
 , звідси Т2 = 35,6 0С.
, звідси Т2 = 35,6 0С. :
: ,
,
 ) і прагне гранично скоротити поверхню рідини.
) і прагне гранично скоротити поверхню рідини. , то поверхневий натяг – це питомий ізобарно-ізотермічний потенціал:
, то поверхневий натяг – це питомий ізобарно-ізотермічний потенціал:  , де
, де  ,
,
 – коефіцієнт пропорціональності;
– коефіцієнт пропорціональності;  – виправлення (60);
– виправлення (60);  і
і  – критична температура і температура досліду відповідно;
– критична температура і температура досліду відповідно;  – поверхневий натяг при початковій температурі;
– поверхневий натяг при початковій температурі;  – поверхневий натяг при температурі досліду.
– поверхневий натяг при температурі досліду. .
.
 ,
,
 – концентрація розчину;
– концентрація розчину;  і
і  – константи.
– константи. на межі розчин – газ кількісно характеризується надлишком речовини (кмоль/м2) в поверхневому шарі у порівнянні з її концентрацією в об’ємі розчину. Як правило, речовини, що мають менший поверхневий у порівнянні з розчинником, знижують поверхневий натяг на границі фаз, а ті, що мають більший – підвищують.
на межі розчин – газ кількісно характеризується надлишком речовини (кмоль/м2) в поверхневому шарі у порівнянні з її концентрацією в об’ємі розчину. Як правило, речовини, що мають менший поверхневий у порівнянні з розчинником, знижують поверхневий натяг на границі фаз, а ті, що мають більший – підвищують. ,
,
 – концентрація розчину, кмоль/м3;
– концентрація розчину, кмоль/м3;  – універсальна газова стала, Дж/(кмоль.К);
– універсальна газова стала, Дж/(кмоль.К);  – зміна поверхневого натягу з концентрацією при незмінній поверхні, м2.Н/кмоль.
– зміна поверхневого натягу з концентрацією при незмінній поверхні, м2.Н/кмоль. ,
, .
.
 ,
,
 – кількість адсорбованої речовини, г;
– кількість адсорбованої речовини, г;  – кількість адсорбенту, г;
– кількість адсорбенту, г;  і
і  – сталі, що визначаються дослідним шляхом.
– сталі, що визначаються дослідним шляхом. для багатьох адсорбентів і адсорбованих речовин коливається в межах від 0,1 до 0,5. Сталі
для багатьох адсорбентів і адсорбованих речовин коливається в межах від 0,1 до 0,5. Сталі 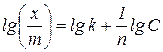 .
. (тобто
(тобто  = ОА;
= ОА;  .
.
 ,
,
 – тиск газу в стані рівноваги;
– тиск газу в стані рівноваги;  і
і  ,
,
 .
.
 є лінійною функцією тиску. Цим можна скористатись для графічного визначення сталих
є лінійною функцією тиску. Цим можна скористатись для графічного визначення сталих  ;
;  ; С = 0,375 кмоль/м3.
; С = 0,375 кмоль/м3.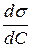 можна визначити графічним методом. Побудуємо графік залежності
можна визначити графічним методом. Побудуємо графік залежності  .
.
 .
.


