
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Внутрішня енергія, теплота, робота
Внутрішня енергія є повним запасом енергії, що міститься в тілі. Цю енергію можна представити у вигляді суми окремих її складових: - енергії поступальної ходи молекул; - енергії обертального руху молекули; - енергії внутрішньомолекулярних коливань атомів; - енергії взаємодії електронів з ядром; - енергії внутріядерної; - енергії взаємодії молекул (потенційна енергія). У технічній термодинаміці необхідно знати тільки зміну внутрішньої енергії при протіканні термодинамічного процесу. Внутрішню енергію зазвичай відлічують від нуля за нормальних умов (відповідає натиск 760 мм рт. ст. і температура 0ºС; 273 К).
Для ідеального газу зміна внутрішньої енергії залежатиме від зміни температури (оскільки немає взаємодії між молекулами). Передача внутрішньої енергії в термодинамічному процесі може відбуватися у формі теплоти або у формі роботи Робота відрізняється від теплоти тим, що пов'язана з видимим, направленим рухом тіл. Якщо енергія у формі роботи відводиться від тіла, то тіло скоює роботу. Інакше робота негативна. Теплота і робота вимірюються в Дж.
Теплоємність
Одним з основних параметрів термодинамічного процесу є теплоємність, яка є кількістю теплоти, яку необхідна підвести до одиниці кількості тіла, щоб воно нагрілося на 1 градус. Одиниця вимірювання теплоємності залежить від одиниці вимірювання кількості речовини, кг, кмоль, ваги 1 м3 речовини. Теплоємність залежить від температури. За визначенням
Перший закон термодинаміки
Перший закон термодинаміки є окремим випадком закону збереження енергії: при теплових процесах неможливе виникнення або знищення енергії. Якби вдалося створити двигун, який проводив би роботу не використовуючи для цього енергію, то це був би вічний двигун першого роду. Друге формулювання першого закону термодинаміки – вічний двигун першого роду неможливий. Аналітичний вираз першого закону термодинаміки для 1 кг газу
Ентальпія
Для зручності багатьох термодинамічних розрахунків зручно використовувати величину, яка є сумою внутрішньої енергії і добутку Р v
де i – ентальпія, Дж/кг (або тепловміст).
u – внутрішня енергія тіла, Дж/кг. Враховуючи рівняння (3.3) можна записати іншу форму першого закону термодинаміки
Термодинамічні процеси
Термодинамічним процесом називається послідовна зміна стану тіла або групи тіл при переході з одного рівноважного стану в інший. При цьому деякі параметри тіла можуть залишатися постійними. Тільки в результаті здійснення процесу може бути перетворення теплоти в роботу. Термодинамічні процеси розділяють на оборотні і необоротні. У оборотному процесі тіло з кінцевого стану повертається в початковий через ту саму послідовність зміни параметрів, що з початкового в кінцевий. У необоротному процесі тіло з кінцевого стану не повертається в початковий через ту саму послідовність параметрів, що з початкового в кінцевий або взагалі не повертається в початковий стан. Всі реальні процеси необоротні. Розглянемо ідеальні оборотні процеси з ідеальним газом (основні оборотні процеси). До основних процесів відносять процес при постійному об'ємі (v=const) – изохорний; процес при постійному тиску (P=const) - ізобарний; процес при постійній температурі (T=const) – ізотермний; адіабатний процес, тобто процес, що протікає без теплообміну між робочим тілом і джерелами теплоти.
Ізохорний процес
Рівняння першого закону термодинаміки для нескінченно малої ділянки процесу:
оскільки v=const то dv=0, тоді
Вся теплота, що підводиться до робочого тіла, йде на зміну його внутрішньої енергії:
Ізобарний процес
З рівняння першого закону термодинаміки
Напишемо рівняння першого закону термодинаміки через ентальпію
оскільки P=const; dP=0, то вся теплота, що підводиться до робочого тіла, затрачується на зміну його ентальпії:
Ізотермічний процес
P v=const (4.11)
|
|||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 237; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.240.178 (0.009 с.) |
 (4.1)
(4.1) (4.2)
(4.2)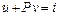 (4.3)
(4.3) (4.4)
(4.4) (4.5)
(4.5)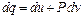
 (4.6)
(4.6) (4.7)
(4.7) (4.8)
(4.8)
 (4.9)
(4.9)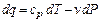
 (4.10)
(4.10)


