
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Витрата повітря на спалювання 1 кг палива
Об'єм повітря, необхідний для спалювання 1 кг твердого або рідкого палива, визначається на основі розрахунку стехіометричних рівнянь реакції горіння. Нижче приведені реакції повного горіння палива:
Відносячи ці рівняння до 1 кг палива і виражаючи витрату кисню в об'ємних одиницях, одержимо необхідний об'єм (м3) кисню на 1 кг кожної складової горючої маси палива:
– для вуглецю
12,01 кг С+32 кг О2=44,01 кг СО2;
– для допалювання 1 кг вуглецю до СО2 потрібне кисню
1 кг С+1,866 м3 О2=1,866 м3 СО2.
Аналогічно ведеться розрахунок для водню:
4 кг Н2+32 кг О2=36 кг Н2О;
1 кг Н2+5,56 м3 О2=11,12 м3 Н2О.
Для сірки:
32 кг Sор+к+32 кг О2=64 кг SO2;
1 кг Sор+к+0,7 м3 О2=0,7 м3 SO2.
Підсумовуючи витрати кисню на спалювання горючих елементів, що містяться в 1 кг палива і віднімаючи кисень палива, одержимо теоретично необхідний об'єм кисню для спалювання 1 кг твердого або рідкого палива,
де Ср, Нр, Sр, Ор –масовий вміст горючих елементів в паливі %, яке беруть на підставі лабораторних аналізів або з таблиць палив;
Для спалення 1 м3 газового палива теоретично необхідний об'єм кисню,
У атмосферному повітрі міститься 21% кисню за об'ємом, тому теоретична його витрата на горіння складає,
Об'їм теоретично необхідного повітря для спалювання 1 кг твердого або рідкого палива,
При спалюванні сухого газового палива розрахунок ведеться за формулою:
У практичних умовах роботи паливних пристроїв не вдається здійснити повне горіння палива з теоретичною кількістю повітря. Причинами цього можуть бути нерівномірна подача повітря, погане перемішування повітря з паливом, недосконалість паливних пристроїв і ін. Для досягнення повноти горіння палива повітря в паливну камеру подають з деяким надлишком Vд>V0. Відношення дійсного об'єму повітря Vд, м3/м3, до теоретично необхідного називається коефіцієнтом надлишку повітря:
звідки дійсний об'єм повітря
Надлишковий об'єм повітря Vизб, м3/м3
Коефіцієнт надлишку повітря залежно від виду палива і способу його спалювання коливається в межах 1,01. 1,5 і вище. Чим краще умови для змішування повітря з паливом, тим надлишок повітря може бути меншим.
Завдання на самостійну роботу:
1. Вивід рівняння стану ідеального газу; 2. Склад і об'єм продуктів спалення 1 кг палива.; 3. Ентальпія продуктів спалення.
Питання для самоперевірки:
1. Який фізичний сенс газової постійної і універсальної газової постійної? 2. Як записати закон Гей-Люссака і Бойля-Маріотта? 3. Які властивості має 1 кмоль будь-якого ідеального газу? 4. Чому газова постійна кіломолю газу називається універсальною? 5. Що називають робочим паливом? 6. Який зв'язок між вищою і нижчою теплотою спалення палива? 7. Що таке умовне паливо? 8. Напишіть реакції повного горіння палива? 9. Як визначити теоретично необхідний об'єм кисню для спалювання 1 кг твердого або рідкого палива, 10. Як визначити теоретично необхідний об'єм кисню, 11. Який склад продуктів спалення палива? 12. Як визначити повний об'єм паливних газів? 13. Як визначити об'єм продуктів спалення газового палива? 14. Як визначити коефіцієнт надлишку повітря при повному спаленні палива? 15. Як визначити ентальпію продуктів спалення палива?
Лекція 2 Тема. Суміші ідеальних газів
План лекції:
2.1. Закон Дальтона; 2.2. Закон Бойля–Мариотта для суміші газів; 2.3. Рівняння стану суміші газів; 2.4. Формули для розрахунку газових сумішей.
Закон Дальтона.
Для дослідження властивостей сумішей газів велике значення має закон, відкритий Дальтоном. Закон формулюється таким чином: якщо суміш складається з газів, які не вступають між собою в хімічні реакції, то кожний газ поводиться так, як ніби він один займає весь об'єм, в якому знаходиться суміш. З цього закону виходить, що кожний газ, що знаходиться в суміші, надає на стінки посудини, в якій укладена суміш, такий тиск, який він надавав би, займаючи сам весь об'єм посудини. Такий тиск називають парціальним. Тиск суміші Рсм, Па, рівний сумі парціального тиску компонентів:
де рi, – парціальний тиск окремих компонентів суміші, Па. Склад суміші може бути заданий масовими g або об'ємними r частками, а також числом молів кожного компоненту. Масову частку i-того компоненту gi визначають за відношенням
де mi – маса i-того компонента, кг; mсм – маса суміші газів, кг; Об'ємну частку i-того компоненту ri визначають за відношенням
де vi – парціальний об'єм i-того компоненту газу, що входить в суміш, м3. Vсм – об'єм суміші газів м3.
|
||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 465; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.98.108 (0.013 с.) |
 .
. , м3/кг за нормальних умов:
, м3/кг за нормальних умов: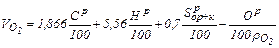 , (1.22)
, (1.22) – густина кисню за нормальних фізичних умов, дорівнює 1,428 кг/м3.
– густина кисню за нормальних фізичних умов, дорівнює 1,428 кг/м3. , м3/м3, розраховується аналогічно:
, м3/м3, розраховується аналогічно: . (1.23)
. (1.23) , м3/м3:
, м3/м3: . (1.24)
. (1.24)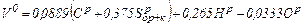 . (1.25)
. (1.25) (1.26)
(1.26) , (1.27)
, (1.27) . (1.28)
. (1.28) . (1.29)
. (1.29) (2.1)
(2.1) (2.2)
(2.2) (2.3)
(2.3)


