
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Уравнение первого закона термодинамики малого элемента процесса
Так как T=const, то dT=0, следовательно, изменения внутренней энергии не происходит, а вся подводимая к телу теплота переходит в работу
Так как в процессе T=const, то и i=const, т.е. не происходит изменения энтальпии.
Адиабатный процесс
Характеристикой адиабатного процесса будет равенство dq=0, т.е. теплота к рабочему телу не подводится и не отводится. Запишем уравнение первого закона термодинамики через энтальпию
После преобразований получаем уравнение
где видно, что
Политропный процесс
Рассмотрим процесс, когда изменяются все параметры, участвующие в процессе. В течение такого процесса к рабочему телу подводится (отводится) теплота q, которая идет частично на изменение внутренней энергии рабочего тела, частично на производство внешней работы. Первую часть теплоты, будем характеризовать коэффициентом α, вторую – β. Оба коэффициента выразим в долях от единицы. Процессы, в которых доля теплоты, идущая на изменение внутренней энергии, в течение всего процесса остается постоянной, носят название политропных. Следовательно, характеристикой политропного процесса будет постоянство величины
или, что то же самое
Последнее соотношение вытекает из уравнения первого закона термодинамики. Очевидно, что
Для бесконечно малого политропного процесса коэффициент α должен быть постоянным. Тогда
отсюда
Уравнение политропного процесса
Для вывода уравнения политропы воспользуемся уравнением первого закона термодинаміки
и
после преобразований
где Полученное уравнение является уравнением политропы.
Показатель политропы можно определить по уравнению
Второй закон термодинамики Если первый закон термодинамики является результатом закона сохранения энергии, то второй закон определяет замкнутые термодинамические процессы или циклы. На диаграммах такие процессы изображаются замкнутыми контурами. В применении к задачам термодинамики второй закон термодинамики может быть сведен к следующему положению: невозможно осуществить цикл в результате только подвода теплоты к рабочему телу или только отвода теплоты от него.
В отличие от «вечного» двигателя первого рода, создающего энергию из ничего, двигатель, действующий при наличии одного источника теплоты, называют «вечным» двигателем второго рода. Тогда второй закон термодинамики можно сформулировать: вечный двигатель второго рода невозможен. Для оценки экономичности прямого цикла используют отношение работы за цикл l к подводимой теплоте q1. Это отношение называют термическим к. п. д. Цикла
В качестве основной характеристики обратного процесса принимается величина холодильного коэффициента ε, равного отношению теплоты, отводимой от охлаждаемого тела q2 к затраченной для этого работе l.
Цикл Карно Очевидно, что в данной конкретной термодинамической системе можно осуществить единственный обратимый цикл. Этот цикл будет обладать максимальной экономичностью. Впервые такой цикл и его свойства были рассмотрены в работах С. Карно. Преобразовав уравнение (7.1) можно получить уравнение для термического к. п. д. прямого цикла Карно.
Цикл Карно может быть не только прямым, но и обратным. Он является наиболее экономичным холодильным циклом. Для обратного (холодильного) цикла Карно холодильный коэффициент будет равен
Приведенная теплота
Отношение количеств подводимой и отводимой к соответствующей абсолютной температуре называется приведенной теплотой. Можно доказать, что произвольный замкнутый цикл можно заменить бесконечно большим количеством (n) циклов Карно. В этом случае предел суммы равен
который, как известно из математики, представляется интегралом, найденным по замкнутому контуру:
Формула (7.5) справедлива только для обратимых циклов. Для необратимого цикла Карно алгебраическая сумма приведенных теплот меньше нуля.
Аналогично предыдущему для необратимого цикла запишем
Интеграл приведенных теплот по замкнутому контуру необратимого цикла меньше нуля.
Энтропия
Функция S, которая имеет бесконечно малое приращением dq/T, называется энтропией
Ее размерность для 1 кг рабочего тела будет Дж/(кг К) – удельная энтропия. Для m кг рабочего тела энтропия определяется как произведение m s=S Дж/кг.
|
||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 169; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.29.73 (0.009 с.) |

 (4.12)
(4.12)
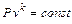 . (4.13)
. (4.13)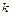 является показателем адиабаты.
является показателем адиабаты.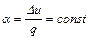 (4.14)
(4.14) (4.15)
(4.15)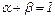 .
.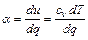 (4.16)
(4.16)
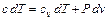 (4.17)
(4.17)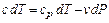 (4.18)
(4.18) (4.19)
(4.19) – показатель политропы.
– показатель политропы. (4.20)
(4.20) (4.21)
(4.21) (4.22)
(4.22)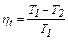 или
или 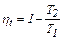 (4.23)
(4.23)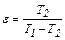 (4.24)
(4.24)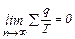 ,
, . (4.25)
. (4.25)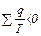
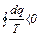 (4.26)
(4.26) (4.27)
(4.27)


