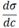Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Поверхностная активность (g) как характеристика поведения вещества при адсорбции.
g = - при c → 0 Чем в большей степени уменьшается поверхностное натяжение с увеличением концентрации адсорбируемого вещества, тем больше поверхностная активность этого вещества и наоборот. 3. Методы определения поверхностного натяжения. Измерение поверхностного натяжения сталагмометрическим методом. Этот метод определения поверхностного натяжения заключается в измерении объѐма или веса капли, медленно отрывающейся от кончика вертикальной трубки, внутренний радиус которой r.В основе метода лежит предположение, что отрыв капли происходит в тот момент, когда еѐ вес Р становится равным силам поверхностного натяжения, действующим вертикально по окружности трубки, т.е. в момент n отрыва капли Р = 2πrζ. Если известны объѐм расширенной части сталагмометра V и плотность жидкости ρ, то вес капли Р можно вычислить по формуле
где g – ускорение силы тяжести. Очевидно, что при отрыве капли должно соблюдаться равенство Обычно проводят относительное определение σ, сравнивая истечение из данного сталагмометра исследуемой жидкости и жидкости с известным поверхностным натяжением. В этом случае пользуются для расчѐта следующей формулой:
для разбавленных водных растворов, плотность которых мало отличается от единицы, формулу можно упростить:
Из полученной формулы следует, что для определения поверхностного натяжения достаточно подсчитать число капель исследуемой жидкости. Изменение поверхностного натяжения биологических жидкостей используется в диагностических целях. Например, поверхностное натяжение плазмы крови значительно изменяется при различных заболеваниях (анафилактический шок, рак, и др.). С возрастом у человека поверхностное натяжение сыворотки крови уменьшается. Из многочисленных методов измерения поверхностного натяжения при биохимических, физиологических и клинических исследованиях чаще всего используют сталагмометрический метод и метод продавливания пузырьков воздуха. Зависимость поверхностного натяжения от природы и концентрации растворенного вещества (ПАВ, ПИВ и ПНВ). Ориентация молекул ПАВ в поверхностном слое. Правило Дюкло-Траубе. Растворѐнные вещества в зависимости от природы могут по-разному влиять на поверхностное натяжение жидкостей. Способность растворѐнных веществ изменять поверхностное натяжение растворителя называется поверхностной активностью. Все вещества по способности изменять поверхностное натяжение растворителя делятся на три группы.
1. Вещества, понижающие поверхностное натяжение, называются поверхностно-активными вещества (ПАВ). По отношению к водным растворам поверхностно активными веществами являются спирты, жирные кислоты и их соли (мыла), сложные эфиры, амины, белки и некоторые другие вещества, имеющие дифильное строение. В молекулах таких веществ различают неполярную (гидрофобную) часть – углеводородный радикал («хвост») и полярную (гидрофильную) часть. Чтобы вещество обладало способностью понижать поверхностное натяжение растворителя, необходимо, чтобы в составе молекулы имелись полярные группы: -ОН, -NH2, -COOH, -SO3др. Мерой способности растворѐнного вещества к понижению поверхностного натяжения раствора является величина производной поверхностного натяжения по концентрации, называемая поверхностной активностью. Единица измерения поверхностной активности названа в честь Дж. Гиббса: 1 гиббс = 10^-6 Дж ∙ м / моль. Поверхностная активность веществ одного и того же гомологического ряда возрастает приблизительно в три раза при увеличении углеводородной цепи на одну метиленовую группу (- СН2-). (Правило Дюкло-Траубе) ПАВ, как и все вещества в зависимости от способности к электролитической диссоциации, делят на электролиты (ионогенные ПАВ) и неэлектролиты (неионогенные ПАВ). Ионогенные ПАВ подразделяют на катионные, анионные и амфотерные. 2. Вещества, повышающие поверхностное натяжение, называются поверхностно-инактивными (ПИВ). К этим веществам относятся сильные электролиты: соли, кислоты, щѐлочи. Ионы этих веществ, образующиеся в результате электролитической диссоциации, взаимодействуют с молекулами воды сильнее, чем молекулы воды между собой. Поэтому значительная часть ионов увлекается молекулами воды внутрь объѐма раствора. Однако некоторые немногие оставшиеся на поверхности создают вблизи поверхности силовое поле, тем самым повышают поверхностное натяжение.
3. Имеются вещества, которые не меняют поверхностное натяжение растворителя. Эти вещества называют поверхностно-неактивными. Молекулы таких веществ в своѐм составе имеют большое число полярных функциональных групп (например, сахароза). Всѐ многообразие зависимостей поверхностного натяжения от концентрации может быть представлено кривыми трѐх типов:
Из графика видно, что для ПАВ < 0, для ПИВ > 0, а для ПНВ = 0. На графике σ0– поверхностное натяжение воды. Отметим, что для ПАВ характерно резкое снижение σ даже при малых концентрациях. По мере роста концентрации ПАВ график становится более пологим и, наконец, переходит в горизонтальную прямую, что означает, что поверхностное натяжение достигло своего минимального значения. Увеличение σ под влиянием ПИВ происходит незначительно, что связано с тем, что концентрация ионов в поверхностном слое незначительна и по составу он близок к чистому растворителю. Отметим, что понятия ПАВ и ПИВ не носят абсолютный характер, они определяются выбранным растворителем, его поверхностным натяжением. 5. Адсорбция, основные термины (адсорбент, адсорбтив, адсорбат, десорбция). Химическая и физическая адсорбция. Под адсорбцией на неподвижной границе раздела фаз понимается накопление одного вещества на поверхности другого. Твѐрдое вещество, на поверхности которого накапливается другое вещество, называется адсорбентом, а поглощаемое вещество – адсорбтивом. Уже адсорбированное вещество называется адсорбатом. Десорбция - процесс, обратный адсорбции В зависимости от природы сил, действующих между адсорбентом и адсорбатом различают физическую и химическую адсорбции. Физическая адсорбция обусловлена межмолекулярным взаимодействием за счёт сил Ван дер-Ваальса или водородной связью. Поэтому для этого вида адсорбции характерны: обратимость, неспецефичность, экзотермичность. Химическая адсорбция осуществляется при взаимодействии адсорбента с адсорбатом с образованием химической связи. Химическая адсорбция: необратима, специфична и локализована
|
||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 932; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.13.201 (0.006 с.) |