
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Металлические и неметаллические свойства химических элементов.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
а) Закономерности, связанные с металлическими и неметаллическими свойствами элементов. 1. При перемещении вдоль периода СПРАВА НАЛЕВО металлические свойства элементов УСИЛИВАЮТСЯ. В обратном направлении возрастают неметаллические. Слева направо в периоде также увеличивается и заряд ядра. Следовательно, увеличивается притяжение к ядру валентных электронов и затрудняется их отдача. 2. При перемещении СВЕРХУ ВНИЗ вдоль групп УСИЛИВАЮТСЯ МЕТАЛЛИЧЕСКИЕ свойства элементов. Это связано с тем, что ниже в группах расположены элементы, имеющие уже довольно много заполненных электронных оболочек. Их внешние оболочки находятся дальше от ядра. б) Закономерности, связанные с окислительно-восстановительными свойствами. Изменения электроотрицательности элементов. 1. СЛЕВА НАПРАВО УСИЛИВАЮТСЯ ОКИСЛИТЕЛЬНЫЕ свойства, а при движении СВЕРХУ ВНИЗ - ВОССТАНОВИТЕЛЬНЫЕ свойства элементов. 2. ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ВОЗРАСТАЕТ тоже СЛЕВА НАПРАВО, достигая максимума у галогенов. 3. При перемещении СВЕРХУ ВНИЗ по группам ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ УМЕНЬШАЕТСЯ. Это связано с возрастанием числа электронных оболочек, на последней из которых электроны притягиваются к ядру все слабее и слабее. в) Закономерности, связанные с размерами атомов. 1. Размеры атомов (АТОМНЫЕ РАДИУСЫ) при перемещении СЛЕВА НАПРАВО вдоль периода УМЕНЬШАЮТСЯ. 2. При перемещении СВЕРХУ ВНИЗ АТОМНЫЕ РАДИУСЫ элементов РАСТУТ, потому что заполнено больше электронных оболочек. Вопрос 3. Строение вещества. Гибридизация орбиталей. Типы химических связей. Потенциал ионизации и электроотрицательность. Строение вещества Все тела состоят из отдельных частиц — молекул и атомов. Молекулы — это наименьшие частицы вещества. Молекулы состоят из атомов. Основные сведения о составе вещества: 1) Все тела состоят из отдельных частиц (молекул и атомов), между которыми есть промежутки. 2) Молекулы непрерывно и хаотично движутся. 3) Молекулы взаимодействуют между собой (притягиваются и отталкиваются). Свойства молекул: 1) Молекулы одного и того же вещества одинаковы. 2) При нагревании промежутки между молекулами увеличиваются, а при охлаждении — уменьшаются. 3) С увеличением температуры, скорость движения молекул возрастает. По типу строения все вещества делятся на молекулярные и немолекулярные. Среди органических веществ преобладают молекулярные вещества, среди неорганических - немолекулярные. По типу химической связи вещества делятся на вещества с ковалентными связями, вещества с ионными связями (ионные вещества) и вещества с металлическими связями (металлы). Вещества с ковалентными связями могут быть молекулярными и немолекулярными. Это существенно сказывается на их физических свойствах. Молекулярные вещества состоят из молекул, связанных между собой слабыми межмолекулярными связями, к ним относятся: H2, O2, N2, Cl2, Br2, S8, P4 и другие простые вещества; CO2, SO2, N2O5, H2O, HCl, HF, NH3, CH4, C2H5OH, органические полимеры и многие другие вещества. Эти вещества не обладают высокой прочностью, имеют низкие температуры плавления и кипения, не проводят электрический ток, некоторые из них растворимы в воде или других растворителях. Немолекулярные вещества с ковалентными связями или атомные вещества (алмаз, графит, Si, SiO2, SiC и другие) образуют очень прочные кристаллы (исключение - слоистый графит), они нерастворимы в воде и других растворителях, имеют высокие температуры плавления и кипения, большинство из них не проводит электрический ток (кроме графита, обладающего электропроводностью, и полупроводников - кремния, германия и пр.) Все ионные вещества, естественно, являются немолекулярными. Это твердые тугоплавкие вещества, растворы и расплавы которых проводят электрический ток. Многие из них растворимы в воде. Гибридизация орбиталей Гибридизация орбиталей - это изменение формы некоторых орбиталей при образовании ковалентной связи для достижения более эффективного перекрывания орбиталей.
Типы химических связей. 1) Ионная (металл + неметалл) 2) Ковалентная (неметалл + неметалл с помощью общих электронных пар) Обменный механизм - в образовании связи участвуют одноэлектронные атомные орбитали, т.е. Каждый из атомов предоставляет в общее пользование по одному электрону: Донорно-акцепторный механизм (координационная связь) — химическая связь между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов одного атома (донора) и свободной орбитали другого атома (акцептора). 3) Металлическая (между атомами металлов, между ионами металлов и общими свободными электронами) 4) Водородная (между водородом одной молекулы и другим более электроотрицательным элементом (O, S, N, F) и с другой молекулой) Потенциал ионизации атома - минимальная разность потенциалов U, которую должен пройти электрон в ускоряющем электрическом поле, чтобы приобрести кинетическую энергию, достаточную для ионизации атома. Электроотрицательность (ЭО) – относительная способность атомов притягивать электроны при связывании с другими атомами. Электроотрицательность характеризует способность атома к поляризации химических связей. Вопрос 4.
|
||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 6681; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.101.151 (0.009 с.) |

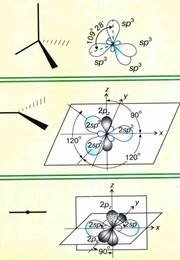 sp3- Гибридизация. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые "гибридные" орбитали, угол между осями которых равен 109°28'. Молекулы, в которых осуществляется sp3- гибридизация, имеют тетраэдрическую геометрию (CH4, NH3).
sp3- Гибридизация. Одна s- орбиталь и три p- орбитали превращаются в четыре одинаковые "гибридные" орбитали, угол между осями которых равен 109°28'. Молекулы, в которых осуществляется sp3- гибридизация, имеют тетраэдрическую геометрию (CH4, NH3). 


