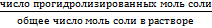Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гидролиз солей. Степень и константа гидролиза, обратимый и необратимый гидролиз. Различные типы гидролиза солей. Влияние температуры и концентрации раствора на гидролиз солей.
Гидролиз – это химическая реакция взаимодействия вещества с водой, при которой происходит разложение этого вещества и воды с образованием новых соединений. Гидролизом соли называется взаимодействие ионов соли с молекулами воды, находящимися в их гидратной оболочке, сопровождающееся образованием слабого электролита с накоплением в растворе ионов Н+ или ОН-. В реакции гидролиза вступают соли, образованные слабой кислотой и слабым основанием, или слабой кислотой и сильным основанием, или слабым основанием и сильной кислотой. Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются. К сильным кислотам относятся: H2SO4 , HCl, HClO4, HMnO4, HNO3 , HBr, HI, HClO3 К сильным основаниям относятся: LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 К слабым кислотам относятся: H2SO3, HF, H2CO3, HClO, HNO2, H2S, H2SiO3, HClO2, H3PO4, HCOOH, CH3COOH К слабым основаниям относятся Cu(OH)2, Mg(OH)2, Al(OH)3, Fe(OH)2, Be(OH)2, Fe(OH)3, NH4OH Гидролиз может быть обратимым и необратимым. При обычных условиях гидролиз идет самопроизвольно только по первой ступени. При сильном нагревании и разбавлении раствора гидролиз может идти по второй и последующим ступеням Обратимый гидролиз Обратимому гидролизу подвергаются: · Соли, образованные сильным основанием и сильной кислотой Соли, образованные сильным основанием и сильной кислотой, не подвергаются гидролизу. В этом случае, гидролиз практически не происходит, т.к. катионы и анионы, образующиеся в растворе при диссоциации соли, слабо поляризуют гидратную оболочку. pH среды не изменяется (рН ≈ 7) NaCl+H2O ≠ · Соли, образованные слабым основанием и сильной кислотой Такое соединение, при ионизации, образует катионы, способные к поляризации гидратной оболочки и анионы, которые их поляризуют слабо. Тогда гидролиз проходит по катиону, при этом среда носит кислый характер, т.е. рН ˂ 7: NH4Cl ↔ NH4+ + Cl— NH4+ + HOH ↔ NH4OH + H+ Cl—+ HOH ↔ реакция практически не идет NH4Cl+ HOH ↔ NH4OH + HCl Если соль образованна слабым основанием многовалентного металла и сильной кислотой, то ее гидролиз будет протекать ступенчато: FeCl2 ↔ Fe2+ + 2Cl—
· Соль, образованная сильным основанием и слабой кислотой Такое соединение в растворе образует слабополяризующие катионы и средне поляризующие анионы. Гидролиз протекает по аниону, и в его результате создается щелочная среда, pH> 7:
NaCN ↔ Na+ + CN— CN— + HOH ↔ HCN + OH— Na+ + HOH ↔ реакция практически не идет NaCN + HOH ↔ HCN + NaOH Если соль образована слабым основанием многовалентного металла и сильной кислотой, то ее гидролиз будет протекать ступенчато: FeCl2 ↔ Fe2+ + 2Cl—
Необратимый гидролиз Этому процесу подвергаются соли, образованные многовалентным катионом от слабого труднорастворимого основания и от аниона слабой летучей кислоты, в результате чего образуются соединения, выходящие из сферы реакции. Такие соли, при ионизации образуют средне поляризующие катионы и анионы, поэтому гидролиз возможен как по катиону, так и по аниону. При этом относительная сила образовавшихся кислоты и основания, будут влиять на характер среды (слабокислая или слабощелочная, pH ≈ 7). Al2S3 + 6HOH ↔ 2Al(OH)3↓+ 3H2S Глубина протекания реакции гидролиза солей количественно характеризуется степенью гидролиза h и константой гидролиза Кг. Степень гидролиза h показывает отношение числа моль соли, подвергшихся гидролизу, к общему числу моль соли в растворе. h = Величина h выражается в процентах или долях единицы. Она зависит от природы соли, концентрации раствора и температуры. Степень гидролиза возрастает с разбавлением раствора и увеличением температуры, так как гидролиз процесс эндотермический. Константа гидролиза По величине константы гидролиза можно судить о полноте гидролиза: чем больше ее значение, тем в большей мере протекает гидролиз. Константа и степень гидролиза связаны соотношением: Kг = С· h 2/(1- h), моль/л Где С – концентрация соли в растворе, h- степень гидролиза Это выражение можно упростить, т.к. обычно h˂˂1, тогда Kг = С· h 2 Для солей, образованных слабым основанием и сильной кислотой, константа гидролиза и константа диссоциации основания связаны соотношением: Kг = KH2O/Kосн Сравнивая величины Kг и Kосн можно качественно определить pH среды. Так, если Kг намного больше Kосн, то среда сильнокислая, при Kг намного меньшей Kосн — среда слабокислая, а если Kг и Kосн сопоставимы, то — среднекислая.
Для солей, образованных сильным основанием и слабой кислотой, константа гидролиза и константа диссоциации кислоты связаны зависимостью Kг = KH2O/Kк-ты Т.е. гидролиз соли протекает тем полнее, чем слабее образующая эту соль, кислота.
|
||||||||||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 1486; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.171.235 (0.007 с.) |