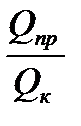Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химико-аналитические свойства сорбентов
К химико-аналитическим свойствам сорбентов относят (СЛАЙД13) - степень сорбции (R, %) - коэффициент концентрирования - pHопт. - сорбционная емкость сорбента (СЕС) - активность сорбента; - время и температура сорбции. (СЛАЙД 14) Степень сорбции показывает, какая доля абсолютного количества микроэлемента содержится в концентрате: R = qк / qпр где qк и qпр– абсолютные количества микроэлемента в концентрате и пробе соответственно. Коэффициент концентрирования К показывает, во сколько раз изменилось соотношение абсолютных масс микроэлемента и матрицы в концентрате по сравнению с пробой. К = где Qк и Qпр– абсолютные массовые количества матрицы в концентрате и пробе соответственно. СЛАЙД 15 Сорбционная емкость сорбента (СЕС мг/г) показывает максимально возможное количество элемента, способное извлекаться данным сорбентом при оптимальных условиях. pHопт. показывают наиболее благоприятную кислотность среды при которой степень сорбции максимальна. 4.2. Статическая и динамическая активность адсорбентов. Основной характеристикой адсорбента является его активность, определяемая весовым количеством вещества, поглощенного единицей объема или веса поглотителя. Статическая активность адсорбента характеризуется максимальным количеством вещества, адсорбированного к моменту достижения равновесия весовой или объемной единицей адсорбента при данной температуре и концентрации адсорбируемого вещества в газо-воздушной смеси. Динамическая активность является характеристикой адсорбента при протекании паровоздушной смеси через слой адсорбента до момента проскока адсорбируемого газа. Если газовая смесь проходит через слой адсорбента, то в начальный период процесса адсорбтив полностью извлекается из газовой смеси. По истечении определенного промежутка времени в газовой смеси, уходящей из поглотителя, начинают появляться заметные, все возрастающие количества адсорбтива (проскок), и к концу процесса концентрация уходящего газа становится равной начальной концентрации паровоздушной смеси. 4.3. Селективные свойства сорбентов. В процессах адсорбции, так же как и в процессах абсорбции, поглощающие вещества адсорбенты обладают селективными свойствами по отношению к поглощаемым газам и парам. Иными словами, применение адсорбционных процессов в качестве метода разделения газовых смесей основано на том, что газовая смесь, приведенная в соприкосновение с адсорбентом, освобождается лишь от одного компонента, в то время как другие оказываются непоглощенными.
Если в процессах абсорбции селективные качества процесса определялись растворимостью или нерастворимостью газа в поглощающей жидкости, то в процессах адсорбции критерием селективных качеств является статическая активность адсорбента. Из смеси газов, приведенных в соприкосновение с адсорбентом, в первую очередь и в значительно большем количестве поглощается газ или пар того вещества, которое имеет более высокую температуру кипения. В большинстве случаев температура кипения поглощаемого газа (например, паров бензола) сильно отличается от температуры кипения инертного газа (например, воздуха) и присутствие инертного газа почти не оказывает влияния на ход процесса. В данном случае поглощение бензола из паровоздушной смеси с парциальной упругостью паров бензола р протекает точно так же, как и поглощение чистых паров бензола, имеющих то же давление. Разделение адсорбционным методом смеси газов, компоненты которой имеют близко лежащие температуры кипения, предоставляет большие трудности или практически невозможно. Синтетические иониты Иониты — твердые нерастворимые вещества, способные обменивать свои ионы на ионы из окружающего их раствора. Обычно это синтетические органические смолы, имеющие кислотные или щелочные группы. Ионообменными смолами называются искусственные органические высокомолекулярные соединения, обладающие ионообменными свойствами. Иониты разделяются на катиониты, поглощающие катионы, и аниониты, поглощающие анионы. Широко применяются иониты для опреснения вод, в аналитической химии для разделения веществ методом хроматографии, в химической технологии. В зависимости от природы матрицы различают неорганические и органические иониты. По «пористости» синтетические иониты можно разделить на гелевые (непористые) и макропористые. В гелевых ионитах поры, как таковые, отсутствуют. Доступность ионообменных групп обеспечивается набуханием ионита, в результате чего в материале образуется пористость. Макропористые иониты получают введением в массу порообразователя – инертного растворителя в процессе синтеза (например, высших углеводородов и спиртов). Часть растворителя задерживается в матрице и после его удаления из гранул получаются смолы с развитой внутренней поверхностью в ненабухшем состоянии и большим объемом пор. Макропористые иониты мало набухают, но благодаря развитой пористой поверхности, очень активны в обменных процессах. Удельная поверхность таких ионитов составляет от 20 до 130 м2/г. Диаметр пор макропористых ионитов варьирует от 200 до 1000 A.
Активные угли - пористое углеродное вещество, обладающее высокими адсорбционными свойствами и гидрофобностью. Cпособность AУ поглощать (адсорбировать) газы, пары и растворённые вещества обусловлена их развитой перовой поверхностью c большим числом так называемых активных центров. Их получают при действии на неактивные паров Н2О или СО2 при 850—950 °С. При этом часть угля выгорает и получается активный уголь, пронизанный весьма тонкими порами с радиусом менее 1 нм. Поверхность покрыта главным образом оксидными группами, причем из-за неоднородности состава оксидов на поверхности физическая адсорбция может сопровождаться как катионо-, так и анионообменными процессами. Особо активными центрами на поверхности являются ребра и углы кристаллитов. Особое место занимают окисленные активные угли, являющиеся селективными полифункциональными катионообменниками. Они весьма устойчивы к химическим, термическим и радиационным воздействиям, их легко получить и регенерировать. Для объяснения механизма адсорбции на углях предложено несколько теорий, предполагающих действие Ван-дер-ваальсовых сил, образование химических комплексов, электрохимическое взаимодействие. Обычный активный уголь хорошо поглощает сильные кислоты и не поглощает щелочи, окисленный - наоборот. Активные угли используют в качестве эффективных сорбентов для извлечения свинца из атмосферного воздуха; Са, Ва и Sr из концентрированных растворов щелочей, солей и других соединений; Сг, Мо и V из воды и рассолов ртутного электролиза. Как правило, определение элементов заканчивается непосредственно в концентрате: прямым сжиганием концентрата в канале спектрального угольного электрода или концентрат облучают потоком нейтронов или определяют элементы в концентрате рентгенофлуоресцентным методом. Окончание анализа может быть другим: после разложения сорбента, содержащего сорбированные компоненты, действием азотной кислотой в полученном растворе компоненты определяют атомно-абсорбционным, спектрофотометрическим и другими методами.
|
||||||
|
Последнее изменение этой страницы: 2017-02-05; просмотров: 520; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.40.47 (0.006 с.) |
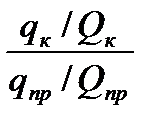 =R
=R