
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Исследование биологической усвояемости ⇐ ПредыдущаяСтр 8 из 8
Важным свойством любого лекарства является биологическая усвояемость (или, кратко, биоусвояемость), которая показывает, насколько хорошо данный препарат всасывается в кровь через желудочно-кишечный тракт. Абсолютная биоусвояемость вычисляется как площадь под кривой (AUC, area under curve) временного профиля концентрации вещества в крови. Процентная (относительная) биоусвояемость является отношением абсолютной биоусвояемости данного вещества при всасывании через желудочно-кишечный тракт к биоусвояемости при введении той же дозы вещества прямо в кровь. С использованием модели было проведено исследование зависимости относительной биоусвояемости пептида гормона роста GHRP-1 от двух биохимических параметров модели (таблица 2) – от скорости поверхностного всасывания KA и от эффективной диффузии в полости D. Исходно все параметры вещества отвечали значениям для пептида гормона роста (таблица 3). Затем увеличивался один из двух параметров KA или D, и строилась зависимость вычисленного значения биоусвояемости от этого параметра. Абсолютная биоусвояемость при прямом введении вещества в кровь вычислялась, исходя из экспоненциального закона эволюции вещества в плазме (однокомпартментная фармакокинетическая модель), по следующей формуле:
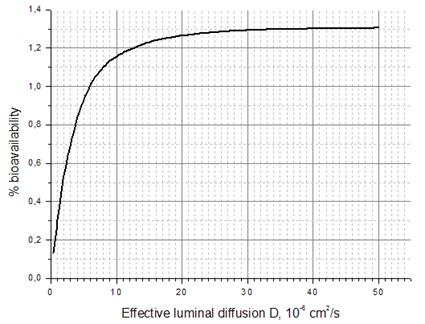
где M 0 обозначает дозу вводимого лекарства. Результаты расчетов относительной биоусвояемости приведены на рисунках (см. рисунок 12, рисунок 13).
Рисунок 12. Зависимость процентной биологической усвояемости пептида гормона роста GHRP-1 Значение процентной биоусвояемости при исходных параметрах для GHRP-1 равняется 0,13%, что находится в соответствии с имеющимися данными [20]. На обоих графиках сначала (при малых значениях KA и D) происходит довольно сильный рост кривых, а затем рост плавно снижается и происходит почти насыщение, которое говорит о том, что значение соответствующего параметра перестает влиять на биоусвояемость, а определяющим становится другой параметр. Также из графиков можно заключить, что для пептида гормона роста GHRP-1 более значимым препятствием к всасыванию является значение эффективной диффузии в полости (это совпадает с выводом, сделанным ранее в разделе 6.2 на основе значения числа Дамкёлера), нежели значение скорости поверхностного всасывания. А именно, пятикратное увеличение эффективной диффузии приводит к четырехкратному увеличению относительной биоусвояемости (вблизи исходных значений параметров), в то время как такое же увеличение скорости поверхностного всасывания не дает никакого увеличения биоусвояемости (тысячные доли процента). Следовательно, при поиске практических способов увеличения биоусвояемости наиболее эффективным окажется тот, который позволит увеличить эффективную диффузию пептида GHRP-1 в полости кишечника.
Рисунок 13. Зависимость процентной биологической усвояемости пептида гормона роста GHRP-1 Анализ результатов и выводы Полученные результаты позволяют сделать некоторые выводы относительно созданной модели переноса и всасывания веществ в ЖКТ. Во-первых, исправленная в настоящей работе макротранспортная модель транспорта в тонком кишечнике дает хорошее соответствие с экспериментальными данными при других биохимических параметрах, чем в [5], что отражается на характеристиках процессов всасывания. Наиболее выраженное различие обнаружено в значении эффективного коэффициента диффузии в полости – по сравнению с [5] он оказался как минимум на порядок меньше (для GHRP-1), являясь барьером к всасыванию и биологической усвояемости. Во-вторых, использованная в работе однокомпартментная фармакокинетическая модель для описания динамики концентрации вещества в плазме оказалась достаточной для довольно точного предсказания профиля концентрации некоторых веществ. Для других веществ степень точности оказалась несколько ниже – в частности, точность падает на существенных временах после начала всасывания (это выражается в занижении уровня концентрации в крови по сравнению с экспериментом), что может говорить об ограниченности простейшей модели распада в крови для данных веществ. Еще одним объяснением заниженного уровня концентрации веществ в крови через некоторое время после начала всасывания может служить отсутствие в представленной модели толстого кишечника, где также может происходить всасывание.
В третьих, разработанная эмпирическая модель опорожнения желудка несмотря на свою простоту оказалась существенной для точного предсказания динамики всасывания ранитидина (см. раздел 6.2). Как сообщается в [13], реабсорбция в тощей и подвздошной кишке 80% воды, попадающей в двенадцатиперстную кишку в форме химуса и эндогенных секреций, не привносит существенных радиальных потоков. Выясним, выполняется ли соответствующее предположение, сделанное в разделе 3.2, о том, что радиальным транспортом воды в полости кишечника можно пренебречь. Средняя радиальная скорость в полости кишечника оценивается как VR ~ 10-8-10-7 см/с [13]. Сравнивая это значение со средней аксиальной скоростью течения, получаем Заключение В настоящей работе представлена гетерогенная модель переноса и всасывания в желудочно-кишечном тракте человека и некоторых животных, состоящая из пространственно распределенной модели транспорта в тонком кишечнике (на основе макротранспортного подхода), эмпирической модели опорожнения желудка и простейшей модели распада вещества в кровеносной системе (в случае лекарств это однокомпартментная фармакокинетическая модель). Исходная макротранспортная модель всасывания в тонком кишечнике [5] была исправлена и дополнена моделью желудка, чтобы иметь более адекватное соответствие экспериментальным данным. Для проведения расчетов была создана программная реализация сложной модели, причем разработка велась с таким расчетом, чтобы впоследствии модель можно было включать в целые комплексы моделей, а также независимым образом модифицировать составляющие части модели (опорожнение желудка, транспорт в кишечнике, распад в крови). С помощью построенной модели проведены расчеты для нескольких веществ. За счет сопоставления результатов моделирования с экспериментальными точками определены биохимические параметры модели (таблица 2) для каждого из веществ, дающие наилучшее соответствие модельных кривых имеющимся опытным данным. Также проведено исследование зависимости биоусвояемости пептида гормона роста GHRP-1 от двух параметров модели (скорости поверхностного всасывания со стенки кишечника и эффективной диффузии в полости) для обнаружения основного барьера к всасыванию вещества при заданных исходных параметрах. Результаты работы частично были опубликованы в статье [36] и представлены на II международной конференции по вычислительной биоинженерии в Лиссабоне, а также на XLVIII научной конференции МФТИ [37]. Несмотря на некоторые ограничения модели (см. раздел 3.2), в достаточно широком диапазоне условий модель может служить для предсказания динамики всасывания лекарств и других веществ в зависимости от принятой дозы и способа приема (перорально, прямым введением в кишечник). Модель также пригодна для распознавания процессов, препятствующих всасыванию конкретных веществ (и, как следствие, уменьшающих их биоусвояемость) с целью последующего поиска эффективных способов увеличения биоусвояемости.
Список использованных источников 1. G. M. Grass, P. J. Sinko, Physiologically-based pharmacokinetic simulation modeling. Advanced Drug Delivery Reviews, 54 (2002), pp. 433-451. 2. L. X. Yu, E. Lipka, J. R. Crison, G. L. Amidon, Transport approaches to the biopharmaceutical design of oral drug delivery systems: prediction of intestinal absorption. Advanced Drug Delivery Reviews, 19 (1996), pp. 359-376. 3. K. S. Blesch, R. Gieschke, Y. Tsukamoto, B. G. Reigner, H. U. Burger, J. L. Steimer, Clinical pharmacokinetic/pharmacodynamic and physiologically based pharmacokinetic modeling in new drug development: the capecitabine experience. Investig. New Drugs, 21 (2003), pp. 195-223. 4. F. P. Theil, T. W. Guentert, S. Haddad, P. Poulin, Utility of physiologically based pharmacokinetic models to drug development and rational drug discovery candidate selection. Toxicology Letters, 138 (2003), pp. 29-49. 5. B. R. Stoll, R. P. Batycky, H. P. Leipold, S. Milstein, D. A. Edwards, A theory of molecular absorption from the small intestine. Chemical Engn Science, 55 (2000), pp. 473-489. 6. P. F. Ni, N. F. H. Ho, J. L. Fox, H. Luenberger, W. I. Higuchi, Theoretical model studies of intestinal drug absorption V. Non-steady-state fluid flow and absorption. Int. J. Pharm., 5 (1980), pp. 33-47. 7. S. J. Firmer, D. J. Guller, Simulation of gastrointestinal drug absorption – I. Longitudinal transport in the small intestine. Int. J. Pharm., 48 (1988), pp. 231-246. 8. B. D. Jeffery, H. S. Udaykumar, Modeling and simulation of peristaltic transport and mixing in the human gastrointestinal tract, Proceedings of IMECE-2002. 9. S. Usha, A. R. Rao, Effects of curvature on the peristaltic transport in a two-fluid system. Int. J. Engn Science, 38 (2000), pp. 1355-1375. 10. P. A. Jumars, Animal guts as ideal chemical reactors: maximizing absorption rates. The American Naturalist, Vol. 155, No. 4. 11. P. A. Jumars, Animal guts as non-ideal chemical reactors: partial mixing and axial variation in absorption kinetics. The American Naturalist, Vol. 155, No. 4. 12. H. Brenner, D. A. Edwards, Macrotransport Processes, – Butterworth-Heinemann (Series in Chemical Engineering), 1993. 13. W. F. Ganong, Review of medical physiology, 17th ed, – Norwalk, Connecticut: Appleton & Lange, 1995. 14. J. N. Hunt, D. F. Stubbs, The volume and energy content of meals as determinants of gastric emptying. J. Physiology, 245 (1975), pp. 209-225. 15. H. C. Lin, G. W. Van Citters, Xiao-Tuan Zhao, A. Waxman, Fat intolerance depends on rapid gastric emptying. Digestive Diseases Sc., Vol. 44, No. 2 (1999), pp. 330-335. 16. A. W. Basit, F. Podczeck, J. M. Newton, W. A. Waddington, P. J. Ell, L. F. Lacey, Influence of polyethylene glycol 400 on the gastrointestinal absorption of ranitidine. Pharm. Research, Vol. 19, No. 9 (2002), pp. 1368-1374. 17. D. C. Corbo, Jue-Chen Liu, Yie W. Chien, Drug absorption through mucosal membranes: effect of mucosal route and penetrant hydrophilicity. Pharm. Research, Vol. 6, No. 10 (1989), pp. 848-852. 18. W. Rubas, N. Jezyk, G. M. Grass, Comparison of the permeability characteristics of a human colonic epithelial (Caco-2) cell line to colon of rabbit, monkey, and dog intestine and human drug absorption, Pharm. Research, Vol. 10, Νο. 1 (1993), pp. 113-118. 19. A. Collett, N. B. Higgs, E. Sims, M. Rowland, G. Warhurst, Modulation of the permeability of H2 receptor antagonists cimetidine and ranitidine by P-glycoprotein in rat intestine and the human colonic cell line Caco-2. J. Pharmacology and Experimental Therapeutics, Vol. 288, Issue 1 (1999), pp. 171-178.
20. J. Svensson, Growth hormone secretagogues. Expert Opinion on Therapeutic Patents, Vol. 10, No. 7, pp. 1071-1080. 21. A. B. Suttle, G. M. Pollack, Kim L. R. Brouwer, Use of a pharmacokinetic model incorporating discontinuous gastrointestinal absorption to examine the occurrence of double peaks in oral concentration-time profiles. Pharm. Research, Vol. 9, No. 3 (1992), pp. 350-356. 22. S. S. Walkenstein, J. W. Dubb, W. C. Randolph, W. J. Westlake, R. M. Stote, A. P. Intoccia, Bioavailability of cimetidine in man. Gastroenterology, 74 (1978), pp. 360-365. 23. R. L. Oberle, G. L. Amidon, The influence of variable gastric emptying and intestinal transit rates on the plasma level curve of cimetidine; And explanation for the double peak phenomenon. J. Pharmacokin. Biopharm. 15 (1987), pp. 529-545. 24. M. F. Williams, G. E. Dukes, R. J. Han, W. D. Heizer, L. J. Hak. Influence of gastrointestinal anatomic site of drug delivery on the absorption characteristics of ranitidine. Pharmacotherapy, 9 (1989), p. 184. 25. H. Lennernas, Does fluid flow across the intestinal mucosa affect quantitative drug absorption? Is it time for a reevaluation? // Pharmaceutical Research, Vol. 12, No. 11 (1995), pp. 1573-1582. 26. Milstein, S. J., Leipold, H., Sarubbi, D., Leone-Bay, A., Mlynek, G. M., Robinson, J. R., Kasimova, M., & Freire, E. (1998). Journal of Controlled Release, 53, 259-267. 27. http://www.vivo.colostate.edu/hbooks/pathphys/digestion/. Pahotphysiology of the Digestive System, Colorado State University. 28. Pascal Eyries. A dynamic distributed-parameter modeling approach for performance monitoring of oral drug delivery systems. Master of Science Thesis, Worcester Polytechnic Institute, 2003. 29. Ryoichi Saitoh, Kiyohiko Sugano, Noriyuki Takata, Tatsuhiko Tachibana, Atsuko Higashida, Yoshiaki Nabuchi, Yoshinori Aso, Correction of Permeability with Pore Radius of Tight Junctions in Caco-2 Monolayers Improves the Prediction of the Dose Fraction of Hydrophilic Drugs Absorbed by Humans // Pharmaceutical Research, Vol. 21, No. 5, May 2005, pp. 749-755. 30. M. E. Dowty, C. R. Dietsch, Improved prediction of in vivo peroral absorption from in vitro intestinal permeability using an internal standard to control for intra- and inter-rat variability // Pharmaceutical Research, Vol. 14, No. 12, 1997. 31. I. J. Hidalgo, K. M. Hillgren, G. M. Grass, R. T. Borchardt, Characterization of the unstirred water layer in Caco-2 cell monolayers using a novel diffusion apparatus // Pharmaceutical Research, Vol. 8, No. 2, 1991. 32. N. M. Idkaidek, N. Abdel-Jabbar, A novel approach to increase oral drug absorption // Pharm. Dev. and Technology 6 (2), 2001, pp. 167-171. 33. H. Gregersen, G.S. Kassab, Y.C. Fung, The zero-stress state of the gastrointestinal tract: biomechanical and functional implications // Digestive Diseases and Sciences, Vol. 45, No. 12 (Dec 2000), pp. 2271-2281. 34. P. Macheras, P. Argyrakis, Gastrointestinal drug absorption: is it time to consider heterogeneity as well as homogeneity? // Pharmaceutical Research, Vol. 14, No. 7, 1997. 35. A. Kalampokis, P. Argyrakis, P. Macheras, Heterogeneous tube model for the study of small intestinal transit flow // Pharmaceutical Research, Vol. 16, No. 1, 1999. 36. D. E. Baburkin, A. V. Evdokimov, Heterogeneous modeling of gastrointestinal transport and absorption // Proceedings of ICCB-2005, Lisboa, 2005. 37. Д. Е. Бабуркин, Моделирование транспорта веществ в желудочно-кишечном тракте: эмпирико-теоретический подход, – Труды XLVIII научной конференции МФТИ, – Долгопрудный, 2005. Приложение А. Алгоритм процедуры идентификации параметров Приведем краткий алгоритм процедуры идентификации неизвестных биохимических параметров модели (таблица 2). Предварительные условия для успешного проведения этой процедуры следующие: · наличие экспериментальных точек в осях «концентрация в плазме» – «время»; · наличие некоторого приближения двух параметров из четырех неизвестных (в данной работе двумя такими «опорными» параметрами были скорость всасывания с поверхности KA и скорость распада в организме KE). Второе условие подразумевает, что имеются некоторые опытные значения, которые могут быть сопоставлены выбранным параметрам. Однако это не означает, что значения этих параметров жестко фиксируются. Для того, чтобы модельная кривая концентрации в плазме достаточно хорошо ложилась на экспериментальные точки, иногда бывает необходимо «шевелить» и эти, исходно заданные параметры. Таким образом, на этой стадии нельзя указать какой-либо точный алгоритм идентификации, можно лишь говорить о методе опытного приближения профиля к наилучшему соответствию.
Однако, после того как значения двух опорных параметров из четырех выбрано (почему их четыре, а не пять, как указано изначально в таблице, объяснено в разделе 6.1), можно привести приблизительный алгоритм идентификации. Основное приближение состоит в том, чтобы считать количество вещества, вышедшее из подвздошной кишки (то есть покинувшее «поле зрения» модели), пренебрежимо малым на рассматриваемых временах. Таким образом, уравнение (9) превращается в:
Подставляя значение «мгновенной» массы в уравнение (29) получаем:
Положение максимума концентрации (он соответствует положению максимума массы, поскольку объем распределения в нашей модели считается постоянным) можно вычислить следующим образом:
Само значение максимума концентрации вычисляется по формуле:
Первым шагом в процедуре идентификации является определения значений (t max, C max) из экспериментального графика. Затем, решая трансцендентное уравнение (39), находится величина
где Y – вычисленная величина (путем подстановки конкретных значений C max и
Решая это уравнение, находим значение β 0, затем по формуле (10) находим соответствующее число Дамкёлера Dam, из которого получаем значение эффективной диффузии:
Значение скорости распада в полости кишечника KD находим, используя формулы (11) и (13), следующим образом:
Таким образом, задав два из четырех неизвестных параметров, остальные два находятся из условия соответствия времени и значения максимума модельной кривой и экспериментального графика. Стоит отметить, что не всегда данным способом можно получить искомые значения параметров, поскольку не при всех значениях «опорных» параметров уравнения (39) и (41) могут быть решены. Это накладывает определенные ограничения на область ранжирования «опорных» параметров, однако вблизи их «первых приближений» (значений, взятых из литературных источников) уравнения (39) и (41) всегда имеют устойчивые решения.
|
|||||||||
|
Последнее изменение этой страницы: 2017-01-19; просмотров: 127; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.190.232 (0.037 с.) |
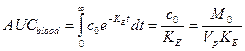 , (36)
, (36)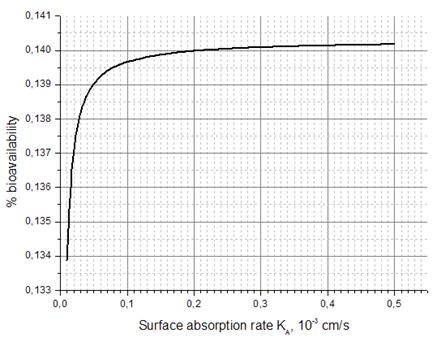
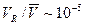 << 1. Следовательно, по сравнению с аксиальной конвекцией, радиальная пренебрежимо мала. Оценив значение безразмерного радиального числа Пекле
<< 1. Следовательно, по сравнению с аксиальной конвекцией, радиальная пренебрежимо мала. Оценив значение безразмерного радиального числа Пекле  , характеризующего вклад радиальных потоков воды в транспорт веществ к всасывающей поверхности по сравнению с диффузией, получим PeR << 1 (для эффективной диффузии порядка 10-6), что говорит о том, что основной механизм «доставки» вещества к всасывающей границе кишечника – это диффузия в полости, и потоками воды в радиальном направлении действительно можно пренебречь.
, характеризующего вклад радиальных потоков воды в транспорт веществ к всасывающей поверхности по сравнению с диффузией, получим PeR << 1 (для эффективной диффузии порядка 10-6), что говорит о том, что основной механизм «доставки» вещества к всасывающей границе кишечника – это диффузия в полости, и потоками воды в радиальном направлении действительно можно пренебречь.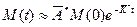 . (37)
. (37)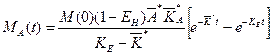 . (38)
. (38)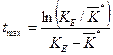 . (39)
. (39)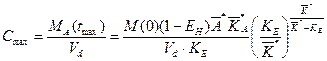 . (40)
. (40) . Ее значение подставляется в уравнение (40), которое можно привести к виду:
. Ее значение подставляется в уравнение (40), которое можно привести к виду: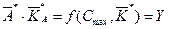 , (41)
, (41) . (42)
. (42)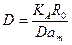 (43)
(43)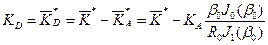 . (44)
. (44)


