
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методи усунення твердості води
Тимчасову твердість усувають кип’ятінням. Якщо вода містить багато гідроген карбонатів, то її зм’якшують додаванням вапна, яке переводить кислі солі у середні: Са(НСО3)2+Са(ОН)2=2СаСО3↓ +2Н2О Якщо твердість води зумовлена наявністю сульфатів і хлоридів кальцію, магнію, то до води додають соду або Са(ОН)2. Осаджуються всі солі магнію і кальцію у вигляді СаСО3 і Mg(OH)2. Іноді використовують ортофосфат натрію або поліметафосфат натрію. Усунути твердість води можна також методом іонного обміну або катіонуванням. Тверду воду слід пропустити крізь шар катіоніту, який здатний обмінювати іони Na+ або H+ на Ca2+ і Mg2+. 2Na –R +Me2+↔Me(R)2+2Na+ Іноді воду потрібно очищувати не тільки від іонів Са2+ і Mg2+, а й від інших іонів. В цьому разі ефективнішим є застосування органічних іонітів спочатку в Н+– формі, потім в ОН- – формі (Н – катіоніти та ОН – аніоніти). Під час проходження води крізь Н –катіоніти та ОН – аніоніти, вода очищується від усіх солей взагалі, тобто таким чином її можна перетворити на дистильовану. Така обробка води називається знесолюванням. Катіоніт легко піддається регенерації, для цього його слід обробити хлоридною або сульфатною кислотою. Внаслідок цього іони Са2+ і Mg2+ переходять у розчин, а катіоніт знову насичується іонами Н+. Для регенерації аніоніту його слід обробити розчином лугу; у цьому разі увібрані аніони будуть витіснятися у розчин, а аніоніт насичуватиметься іонами ОН-. Лабораторна робота № 7 Визначення твердості води за допомогою Трилону Б Правила техніки безпеки: дотримуватися загальних правил безпеки при роботі в хімічних лабораторіях. Необхідні прилади і реактиви: бюретка на 25 мл –1 шт., піпетка на 20 мл –1 шт., конічні колби на 200-300 мл –3 шт., розчини: розчин трилону Б, розчин буферної суміші, індикатор. Виконання досліду Трилонометрічний метод засновано на змінюванні в еквівалентній точці забарвлення розчину, який містить іони Ca2+ і Mg2+, та якийсь індикатор, а також при доливанні до досліджуваного розчину трилону Б. Трилон Б – це двонатрійова сіль етилендіамінотетраоцтової кислоти
яка утворює стійкі комплекси з іонами двовалентних металів, зокрема з іонами кальцію і магнію.
Використовують індикатори (див. табл. 5.1) еріохромчорний Т (спеціальний ЕТ-00), кислотний хромсиній К та кислотний хромтемносиній. Індикатори змінюють забарвлення не тільки від зміни концентрації іонів Са2+ і Mg2+, а від рН розчину. Тому при титруванні підтримують рН близько 10, для чого додають до розчину буферну суміш. Готування буферної суміші: змішати 100 мл 20%-ного розчину NH4Cl і 100мл 20%-ного розчину NH4OH. Розвести дистильованою водою до 1л. Таблиця 5.1 Зміна кольору розчинів індикаторів у лужному середовищі
У конічну колбу піпеткою налити потрібну кількість досліджу вальної води (20 мл), додати 50 мл дистильованої води, долити 5 мл буферного розчину та 4-5 крапель індикатора, добре перемішати і повільно титрувати 0,05Н розчином Трилону Б до зміни забарвлення індикатора (див.табл.1). Кінець титрування легше встановити, якщо поряд поставити колбу з перетитрованою пробою і титрувати до такого самого кольору. Твердість води обчислити за формулою: Са2+ і Mg2+ = де V – об’єм розчину Трилону Б, що пішов на визначення (у мл); N – нормальність Трилону Б. Після визначення твердості води зробити висновок щодо того, якою є вода (м’якою, середньою, твердою чи дуже твердою). Контрольні запитання 1. Які іони обумовлюють твердість води? 2. Що складає загальну твердість? 3. У яких одиницях висловлюють твердість води? 4. Чим відрізняються постійна і карбонатна твердість? 5. Що називають знесолюванням? 6. Чим шкодливе застосування твердої води у промисловості? 7. Які методи усунення твердої води? 8. Яку твердість неможливо усунути кип’ятінням? ОКИСНО-ВІДНОВНІ РЕАКЦІЇ Теоретична частина Окисно-відновні реакції (ОВР) - це реакції, в яких внаслідок обміну електронами змінюється ступень окиснення елементів. Частинка, що в процесі ОВР втрачає електрони, окислюється і є відновником (В). Частинка, що приймає електрони, відновлюється і є окисником (O).
Наприклад: Zn0 + H+Clˉ ® Zn+2Cl2ˉ + H20 У процесі реакції ступінь окиснення цинку підвищується, тобто Zn віддає електрони, окислюється і є відновником: (В) Zn0 - 2ē ® Zn+2 Іони водню H+ приймають електрони, відновлюються і є окисниками: (O) 2H+ + 2ē ® H20. У залежності від ступеня окиснення один і той же елемент може виявляти різну ОВ-здатність. В найвищому ступені окиснення (ВСО) елементи виявляють тільки окисні властивості. У нижчому ступені окиснення (НСО) − тільки відновні. У проміжному − окисно-відновну подвійність, тобто можуть бути і окисником, і відновником в залежності від партнера. При підборі коефіцієнтів у рівнянні ОВР користуються методом електронного балансу: число електронів, прийнятих окисником дорівнює числу електронів, що віддаються відновником. Для прикладу розглянемо наступну реакцію: Mg + H2SO4 ® MgSO4 + H2S + H2O. Підбір коефіцієнтів в ОВР здійснюємо за такою схемою. а) Визначаємо ступінь окиснення кожного елемента всіх речовин, що приймають участь у реакції: 0 +1 +6 −2 +2 +6 −2 +1 −2 +1 −2 Mg + H2SO4 ® MgSO4 + H2S + H2O б) Записуємо електронні рівняння напівреакцій окиснення і відновленнядля елементів, що змінили ступінь окиснення у процесі реакції, і визначаємо окисник і відновник:
(O) S+6 + 8ē ® S−2 8 1 Складаємо електронний баланс. Для цього між кількістю електронів, що їх віддав відновник (2), і кількістю електронів, що їх приєднав окисник (8), знаходимо спільне найменше кратне. Воно дорівнює 8. Розділимо 8 на 2 і одержимо коефіцієнт 4 для магнію. Поділимо 8 на 8 і одержимо коефіцієнт 1 для сірки. в) Отримані за електронним балансом коефіцієнти переносимо в схему реакції: 4Mg + H2SO4 → 4MgSO4 + H2S + H2O На цій стадії ми маємо вірні коефіцієнти для окисника, відновника і продуктів їх перетворень. г) Далі зрівнюємо інші елементи у такому порядку: катіони (крім водню), аніони, водень і нарешті перевіряємо баланс по кисню. У даній реакції крім однієї молекули H2SO4, що є окисником, ще 4 молекули кислоти потрібні для зв'язування 4 іонів Mg2+. Усього необхідно 1 + 4 = 5 молекул H2SO4: 4Mg + 5H2SO4 → 4MgSO4 + H2S + H2O. Далі зрівнюємо кількість атомів водню в лівій та правій частинах реакції. Для цього перед водою ставим коефіцієнт 4. В останню чергу перевіряємо кількість атомів кисню в лівій та правій частинах схеми. У підсумку одержуємо таке рівняння реакції: 4Mg + 5H2SO4 → 4MgSO4 + H2S + 4H2O. Учасники однієї напівреакції, що розглядаються сумісно, називаються окисно-відновною системою, або ОВ-парою. Лабораторна робота № 8 Окисно-відновні реакції Правила техніки безпеки: дотримуватися загальних правил безпеки при роботі в хімічних лабораторіях. Необхідні прилади і реактиви: пробірки, розчини ацетату свинцю, перманганату калію, сірчаної кислоти, соляної кислоти, азотної кислоти, луги (NaOH або KOH), сірководнева вода, пероксид водню, кристали диоксиду свинцю та сульфіту натрію, шматочки міді, концентровані азотна та сірчана кислоти. Виконання досліду
|
|||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 382; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.53.209 (0.011 с.) |


 НООСН2С CH2COONa
НООСН2С CH2COONa


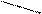
 мекв/л,
мекв/л,




